- مقدمه
مهمترین عامل افزایش تولید برنج در سال های اخیر، افزایش تولید در واحد سطح ميباشد و این عمل با استفاده از روش های نوین به نژادی سرعت بیشتری گرفته است. به دلیل این که کشور ما یکي از مصرفکننده های بزرگ برنج است، این نیاز به طور جدی احساس ميشود که محققین کشور هرچه سریعتر از این روش ها برای اصلاح ارقام داخلي استفاده نمایند. البته لازم است در شروع برنامه های تحقیقاتي هر کدام از این روش ها را برای هر رقم خاص بهینه نمود. لازمه شروع هر برنامه اصلاحي وجود تنوع ژنتیکي است که امروزه محققین با کمبود این تنوع مواجه مي باشند. یکي از روش هایي که ميتواند در حل این مشکل به به نژادگران یاری رساند، استفاده از القاء جهش ميباشد. جهش یا جهش به عنوان تغییر ناگهاني در مواد ژنتیکي تعریف شده است که بخشي از پدیده های اساسي مربوط به حیات را تشکیل ميدهد. به طور کلي به تغییرات ارثي ناگهاني در موجود زنده، جهش گویند. جهش ممکن است خودبخودی و یا القایي باشد. جهش خودبخودی ممکن است ناشي از خطاهای متابولیسمي باشد که به آن خودبخودی واقعي گویند و یا ناشي از عوامل ناشناخته محیطي مثلاً اشعه ماوراء بنفش و سایر عوامل طبیعي باشد. از آنجا که فراواني جهش های طبیعي در شرایط معمول به شدت پایین است، القای جهش مصنوعي و اصلاح از طریق آن، روشي سودمند در افزایش تنوع در گیاهان است جهشي که با به کار بردن مواد شیمیایي در موجودات ایجاد مي شود، جهش القایي نامیده ميشود. هر دو نوع جهش خودبخودی و القایي در اغلب موارد برای موجود حامل آن ها، زیان بار هستند. با این وجود، از آنجا که تغییرات ناشي از جهش تصادفي است، گاهي اوقات و هر چند نادر، جهشي اتفاق ميافتد که به نفع موجود بوده و موجب افزایش توانایي بقاء، رشد و تولیدمثل ميگردد. نوترکیبي بین مواد ژنتیکي جدید حاصل از جهش و مواد ژنتیکي موجود، طیف وسیعي از مواد متنوع ژنتیکي را به وجود مي آورد که از بین آن ها، ژنوتیپ هایي که سازگاری بهتری با محیط دارند باقي مانده و تکثیر مي یابند و آن هایي که از سازگاری ضعیفي برخوردارند، از بین خواهند رفت. بر این اساس، اصلاح کنندگان گیاهي به القای جهش به منظور دستیابي به تنوع ژنتیکي مورد نظر مبادرت ميورزند. اصلاح از طریق جهش یک فناوری کارآمد در دستان به نژادگران است که به شکستن ترکیبات آللي نامطلوب کمک و تغییرات ژنتیکي مطلوبي ایجاد مي کند. طبق اطلاعات پایگاه داده تنوع ناشي از جهش فائو تا کنون بیش از 820 رقم جهش یافته برنج از طریق اصالح جهش در سراسر جهان ایجاد شده اند. در بهنژادی، در نظر گرفتن فاکتورهای اقتصادی و مدت زمان اجرای پروژه ضروری است. معمولاً زماني از اصلاح به روش جهش استفاده مي شود که صفت در ژرمپالسم گیاه موجود نباشد و یا امکان انتقال آن میسر نگردد و یا ممکن است برای اهلي کردن گونه های وحشي بکار گرفته شود. اتم های رادیواکتیو در واقع اتم های ناپایدار دارای انرژی یا جرم اضافه مي باشند که برای رسیدن به حالت پایدار، انرژی جرم اضافه را به صورت چهار پرتو یون ساز اولیه شامل آلفا، بتا، گاما و نوترون آزاد مي سازند. پرتوهای گاما نتیجه بازگشت هسته به حالت پایدار خود ميباشند. پرتوهای ایکس نیز از جنس پرتوهای گاما بوده و هر وقت که یک الکترون مداری در یک اتم به حالت پایدارتر خود انتقال ميیابد ایجاد مي گردند. پرتوهای ایکس و گاما از پرتوهای الکترومگنتیت بوده و در پرتوتابي بذور یا بافت رویشي گیاه کاربرد زیادی دارند. پرتو گاما نسبت به پرتو ایکس، دارای طول موج کوتاه تر با انرژی بیشتر در واحد پروتون ميباشد. چشمه های تولید پرتو گاما اغلب در گلخانه ها ، اطاقک های مورد استفاده قرار ميگیرند و مزارع مصنوعي کشت. زمانيکه عامل موتاژن بر تودهای از سلول مانند بذر، سلول های بافت مریستمي و سایر اندام های گیاه اثر ميگذارد هر سلول ميتواند جهش یابد. نتاج سلول های موتانت و همچنین سلول های غیرموتانت مجاور دارای ژنوتیپ های متفاوت خواهند بود. اولین گام در این مسیر، انتخاب والدین مناسب ميباشد. بدین معني که والدین مي بایست سازگار، پرعملکرد و دارای تعداد معدودی عیب باشند. البته مي توان برای ایجاد تنوع در صفات کمي و کیفي، والدین را تصادفي انتخاب کرد. برای اینکه حداکثر گیاهان موتانت در نسل دوم به دست آید، دز مناسب باید حداکثر گیاهان بارور در نسل اول را تولید کند. با کاربرد تکنیک اصلاح از طریق جهش مي توان گیاهاني با توانایي بالا در مناطق اقلیمي نامناسب که دارای نقاط ضعفي مانند ترشح مواد سمي و سایر مواد مضر، ریزش دانه و یا دوره طولاني غیر فعال بذر مي باشند را اصلاح نمود. در سال های اخیر، عالقه به تجدید حیات جهش به چشم مي خورد و آن به دلیل مزایای زیاد استفاده از آن به صورت ادغام شده با تکنیک کشت بافت باشد. دلایل عمده ای که باعث استفاده از روش کشت بافت در اصلاح از طریق جهش شده است، عبارتند از امکان بررسي جمعیت های بیشتر در زمان کمتر و اطمینان به خلوص موتانت ها در مقایسه با آزمایشات گلخانه ای و مزرعه ای روش های مختلف بیوتکنولوژی مانند ریزازدیادی یا تولید دابل هاپلوئیدی مي توانند گام هایي سریع، ساده تر و ارزان تر در رسیدن به اهداف اصلاحي باشند. تولید کالوس در گیاهان تک لپه ای معمولاً مشکل تر از گیاهان دولپه ای صورت مي گیرد. به همین دلیل، برای القا و تشکیل کالوس، نیاز به اضافه کردن هورمون های مصنوعي ميباشد. میزان موفقیت در رشد کالوس و باز زایي گیاه در غالت بستگي زیادی به نوع ریزنمونه جدا شده دارد. به طور کلي، قسمتهای رویشي گیاهان نسبت به قسمت های زایشي، آمادگي بیشتری برای باز زایي دارند و قابلیت ژنتیکي باز زایي در این خصوص در تمام ارقام وجود دارد. اگرچه جنین نابالغ یکي از مناسبترین ریز نمونهها در کشت بافت این غلات ميباشد، اما به عنوان ریزنمونه دارای برخي از معایب نیز ميباشد؛ از جمله اینکه در دسترس بودن آنها محدود به دوره کوتاهي از زمان رشد در سال ميباشد و نیز جداسازی سخت و مشخص کردن مرحله کشت مناسب آن مشکل ميباشد. اما به دلیل سهولت استفاده از جنین رسیده، پژوهشگران ترجیح ميدهند از این نوع جنین برای مطالعه خود به جای جنین نارس استفاده نمایند. جنین های بالغ به دلیل در دسترس بودن در هر فصل از سال، جداسازی آسان و حداقل تغییر پذیری و وضعیت فیزیولوژیکي آن به عنوان یک جایگزین موثر برای جنین های نابالغ ميباشد. اصلاح از طریق جهش، یک رویکرد مهم در زمینه به نژادی است که به خصوص در برنج باعث توسعه و رها سازی تعداد زیادی ارقام اصلاح شده گردیده است. بنابراین هدف از انجام آزمایش حاضر، تعیین دز مناسب القاء جهش برای ایجاد تغییرات ژنتیکي در بافت کالوس حاصل از جنین بالغ و نابالغ در دو رقم برنج نعمت (رقم اصلاح شده) و طارم محلي (رقم بومي) بود.
- مواد و روش ها
- مواد گیاهی
بذور دو رقم مورد استفاده در این تحقیق (طارم محلي و نعمت) از مؤسسه تحقیقات برنج آمل تهیه گردید. برای تهیه جنین بالغ از بذر استفاده شد اما برای تهیه جنین نابالغ، از پانیکول های حاصل از کشت هیدروپونیک استفاده شد. در کشت جنین بالغ، پس از گذشت 24 ساعت از پخش محیط کشت در داخل پتری ها و آماده کردن بذور ضد عفوني، لامینار و وسایل مورد نیاز برای کشت، ابتدا بذور ضدعفوني شده چندین مرتبه توسط آب مقطر اتوکلاو شده شستشو داده شدند و سپس جنین ها توسط پنس و تیغ جراحي از آندوسپرم بذر جدا شده و تعداد 10 عدد از آن ها داخل هر پتری کشت گردید. قسمت برش خورده جنین به سمت بالا و نوک جنین در محیط کشت قرار داده شد. برای کشت جنین نابالغ ابتدا پانیکول هایی که قبلاً زمان شروع گرده افشاني آن ها مشخص شده بود و مدت 15 روز از گرده افشاني آن ها مي گذشت، انتخاب گردید و برای کشت به آزمایشگاه انتقال داده شد. در آزمایشگاه بذوری که آندوسپرم آن ها به صورت شیری بود از پانیکول جدا و با همان روش ضدعفوني بذور بالغ، ضدعفوني شدند. با توجه به نتایج بهینه سازی اولیه شرایط محیط کشت، برای رقم نعمت از محیط کشت کالوس زایي حاوی 5/0 میلي گرم در لیتر توفوردی و 1 میلي گرم در لیتر کازئین و برای رقم طارم، محیط کشت حاوی 5/1 میلي گرم در لیتر توفوردی همراه با 1 میلي گرم در لیتر کازئین در هر دو نوع کشت جنین بالغ و نابالغ استفاده شد.
- محیط کشت باز زایی
محیط کشت باززایي پرتودهي شده برای رقم نعمت در هر دو نوع ماده گیاهي، محیط کشت موراشیگ و اسکوگ (MS)تکمیل شده با دو میلي گرم در لیتر بنزیل آمینو پورین(BAP)، دو میلي گرم در لیتر کینتین (KIN)و یک میلي گرم در لیتر ایندول استیک اسید (IAA) بود. در رقم طارم محلي نیز در هر دو نوع ماده گیاهي از محیط کشت پایه MS تکمیل شده با چهار میلي گرم در لیتر BAP،5/0 میليگرم در لیتر IAA، 5/0 میلي گرم در لیتر نفتالین اسید استیک (NAA)و پنج میلي گرم در لیتر کازئین هیدرولیزات استفاده شد. در مرحله باززایي پس از انتقال کالوس ها به داخل شیشه های حاوی محیط کشت، کالوس ها به مدت 24 ساعت در اطاقک رشد در دمای 38 درجه سانتي گراد و فتوپریود 16 ساعت نور و 8 ساعت تاریکي قرار داده شدند. پس از 24 ساعت درجه حرارت به 1±30 درجه سانتي گراد رسانده شد.
- پرتودهی
کالوس های مناسب بر اساس روش های تعیین شده، قبل از انتقال به محیط کشت باززایي به آزمایشگاه گاماسل انتقال داده شد و با دزهای،20 ،30 ،40 50 و 60 گری (GY)در معرض تابش پرتو گاما قرار گرفتند. کالوس های پرتوتابي شده در آزمایشگاه کشت بافت به محیط کشت باززایي منتقل شده و در اتاقک رشد به همراه تیمار شاهد (کالوس پرتودهي نشده) در شرایط باززایي قرار گرفتند. صفات اندازهگیری شده در مراحل مختلف شامل درصد کالوس زایي، سرعت رشد کالوس، درصد رطوبت کالوس و درصد باززایي بود. برای انجام مرحله دزیابي پرتو گاما کالوس های ایجاد شده قبل از انتقال به محیط کشت باززایي، مورد تیمار پرتو گاما قرار گرفتند و سپس هریک از ارقام به محیط کشت باززایي مربوط به خود منتقل شدند. پس از پرتودهي کالوس ها و انتقال آنها به محیط کشت باززایي، درصد رطوبت، سرعت رشد بر اساس وزن کالوس، سرعت رشد بر اساس قطر کالوس و درصد باززایي اندازه گیری شد.
- تجزیه داده ها
آزمایش به صورت فاکتوریل سه عاملي (رقم، پرتو و جنین) در قالب طرح کاملا تصادفي با چهار انجام گردید. تجزیه داده ها با استفاده از نرم افزارهای آماری MSTAT-C و SAS انجام شد. از تبدیل زاویهای برای داده های درصدی غیر نرمال و از تبدیل جذری برای داده های عددی غیر نرمال استفاده شد. مقایسه میانگین به روش دانکن در سطح احتمال پنج درصد صورت گرفت.
- نتایج و بحث
- درصد باززایی پس از پرتودهی
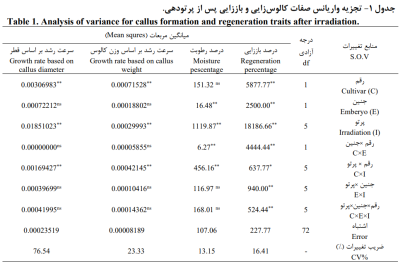
نتایج تجزیه واریانس صفات کالوس زایي و باززایي پس از پرتودهي آن در جدول 1 ارائه شده است. پس از پرتوتابي، اثر رقم بر درصد باززایي، سرعت رشد بر اساس وزن و سرعت رشد قطر کالوس و اثر نوع جنین بر درصد باززایي و درصد رطوبت معني دار شد. اثر پرتو برای تمام صفات مورد بررسي معنيدار بود. اثر متقابل رقم×جنین نیز فقط برای درصد باززایي و درصد رطوبت معنيدار شد. اثر متقابل رقم×پرتو برای تمام صفات معني دار شد. اثر متقابل جنین×پرتو و رقم×جنین×پرتو فقط برای درصد باززایي معنيدار شدند (جدول 1).
- منابع
- Bagheri, L., Amiri-Khah, R., Noori, M., & Mozafari, K. 2017. Effect of gamma irradiation on growth and determine optimum dose in order to induce genetic variation in landrace rice (Oryza sativa L.) cultivars. Journal of Crop Breeding, 9(21), 130-138. [In Persian].
- Farsi, M., & Bagheri, A. 2004. Principles of Plant Breeding. Jdm Press. [In Persian]. Bagheri, L., Mosleh, E., & Fatolahi, H. 2008. Using gamma rays to induce mutations in the somatic callus of rice (Oryza sativa). The Second National Congress on Nuclear Technology Application in Agricultural and Natural Resource Sciences. Karaj, Iran. [In Persian].
- Ahloowalia, B. S. 1997. In vitro radiation induced mutagenesis in potato. In: The impact of biotechnology in agriculture. Sangwan RS, Sangwan Noreel BS (Eds). Klumer Academic publisher, Dordrecht, Netherlands, 39-46. 10.1007/978-94-009-0587-0_4
- 1995. Induced mutations and molecular techniques for crop improvement. Proc. FAO.IAEA symposium, Vienna 1995. IAEA, Vienna.
- Arulbalachandran, D., Mullainathan, L., Karthigayan, S., Somasundaram, S. T., & Velu, S. 2010. Genetic variation in mutants of black gram (Vigna mungo (L.) Hepper) evaluated by RAPD Markers. Journal of Crop Sciences and Biotechnology, (1), 1-6.
- Asencion, A. B. 1977. Mutation breeding manual. Proc. FAO.IAEA symposium, Vienna 1985. IAEA. 9201150776
- Babaei, A. R. 2010. Radio sensivity studies of morpho-physiological characteristics in some Iranian rice varieties (Oryza sativa L.), In M1 generation. African Journal of Agricultural Research, 5, 2124- 2130. 10.5897/AJAR10.234
- Basri, M. 2005. Nuclear techniques used in agricultural research in turkey. Ankara nuclear agriculture and animal sciences research center. https://inis.iaea.org/search/search.aspxorig_q=RN:31000907
- Bregitzer, P. 1992. Plant regeneration and callus type in barley: Effects of genotype and culture medium. Crop Science, 32, 1108-1112. https://doi.org/10.2135/cropsci1992.0011183X003200050007x
- Bronzema, E. B. F., Redig, P., Oostveen, W. J. F., Onckelen, H. A., & Lammeren, A. A. M. 1996. Uptake and biochemical analysis of 2,4-D in cultured zygotic embryos of Zea mays L. Plant Physiology, 149, 363-371. 10.1016/s0176-1617(96)80135-0
- Da Luz, V. K., de Oliveira, V. F., Maltzahn, L. E., & Venske, E. 2020. Mutation Breeding for Rice Grain Quality: Aspects, Considerations, and Promising Results. In: Costa de Oliveira, A., Pegoraro, C., Ebeling Viana, V. (eds) The Future of Rice Demand: Quality Beyond Productivity. Springer, 1-10. https://doi.org/10.1007/978-3-030-37510-2_15
- Gasol, S. S., Das, A., Gopal, J., Minocha, J. L., Chopra, H. R., & Dhaliwal, H. S. 2001. In vitro induction of variability through radiation for late blight resistance and heat tolerance in potato. Plant breeding and genetics section. joint FAO.IAEA division international atomic energy agency wagramer strasse 5 P.O. Box 100 A-1400 Vienna, Austria, 1-8. https://www.osti.gov/etdeweb/biblio/20181058
- Gholami, A. A., & Tarinejad, A. 2018. Callus induction and regeneration of bread wheat cultivars from Different explants, Journal of Cell & Tissue, 9(1), 37-56.
- Hagio, T., Ichiri, S. S., & Yamada, T. 2002. Efficient plant regeneration through morphogenesis in Japanese commercial variety of wheat, In Vitro Cell Development of Biology, 38, 1394- 1396.
- Lapade, A. G., Veluz, A. M. S., Marbella, L. J., Barrida, A. C., & Rama, M. G. 2002. Mutation breeding in vegetatively propagated crops in the Philippines. Philippine nuclear research institute. Commonwealth avenue, Diliman, Quezon City. 1- 10. https://link.springer.com/chapter/10.1007/978-94-017-0956-9_6
- Leifert, C., Pryca, S., Lumsden, P. J., & Waites, W. M. 1992. Effect of medium acidity on growth and rooting of different plant species growing in vitro. Plant Cell Tissue Culture, 30, 171- 179. https://link.springer.com/article/10.1007/BF00040019
- Micke, A., Donini, B., & Maluszynski, M. 1991. Induced mutations for crop improvement. Gamma field symposia No.30. Inst. of radiation breeding, NIAR, MAFF, Japan, 1- 21. Corpus ID: 89223076
- Monirul Islam. M., Mahatalat A., & Debabrata, M. 2005. In Vitro Callus Induction and Plant Regeneration in Seed Explants of Rice (Oryza Sativa L.). Research Journal of Agriculture and Biological Sciences, 1(1), 72- 75. https://www.researchgate.net/publication/266456925
- 2018. Joint FAO/IAEA Mutant Variety Database. International Atomic Energy Agency, Vienna. Available at: http://mvd.IAEA.org (accessed April 2021).
- Novak, F. J. 1991. Plant tissue culture techniques for mutation breeding. Joint FAO. IAEA programme IAEA laboratories-seibersdorf, Austria Plant Breeding, 127- 132. https://link.springer.com/chapter/10.1007/978-3-319-90698-0_6
- Omiya, H., & Ken, I. 2004. Improvement of crop productivity and mutation. Institute of radiation breeding NIAS Gamma field symposia number, 43 ISSN04351096.https://openlibrary.org/books/OL17725516M/Improvement_of_crop_productivity_and_mutati on
- Pandey, S. K., Ramesh, B., & Gupta, P. K. S. 1994. study on effect on genotype and culture medium on callus formation and plant regeneration in rice (Oryza sativa L.). Indian Journal of Genetic, 54 (3), 293- 299.
- Rashed, M., Abou Deif, M., Abdel Hady, A., & Fahmy, K. H. 2000. Effect of gamma irradiation on maize embryo culture regenerated plants. 8th. Conf. Agric. Dev. Res. Fac. Agric. Ain Shams Univ. Annal. Agriculture Science, 2, 765,05701783.https://www.cabdirect.org/cabdirect/abstract/20043097457
- Snustad, D. P., & Simmons, M. J. 2015. Principles of genetics. 130-138. https://books.google.com/books/about/Principles_of_Genetics.html?id=NBB0CgAAQBAJ
- Soeranto, H., Sobrizal, I., & Manurung, S. 2002. Biotechnological approach in crop improvement by mutation breeding in Indonesia. Proceeding of the workshop on plant mutation breeding. 20-24 August 2001, Bangkok, Thailand, 56- 67. https://www.osti.gov/etdeweb/biblio/20300524
- Stadler, L. J. 1930. Some genetic effects of X-rays in plants. Heredity, 21, 3-19. https://doi.org/10.1093/oxfordjournals.jhered.a103249
- Sukekiyo, Y., & Kimura, Y. 1991. Somaclonal variation in protoplast-derived rice plants. Gamma Field Symposia No.30. Inst. of radiation breeding, NIAR, MAFF, Japan, 43- 58.
- Yan, L., Li, X., & Wu, D. 2010. The comparison in tissue culture ability of mature embryo in different cultivars of rice, Agricultural Sciences in China, 840-846.
- Yu, G., Wang, J., Miao, L., Xi, M., Wang, Q., & Wang, K. 2019. Optimization of mature embryo-based tissue culture and Agrobacterium-mediated transformation in model grass Brachypodium distachyon, Internationl Journal of Molecular Science, 20(21), 5448.
- Zhen, H. R. 2001. In vitro technique for selection of radiation induced mutants. Plant breeding and genetics section joint FAO.IAEA division international atomic energy agency wagramer strasse 5 P.O. Box 100 A-1400 Vienna, Austria. IAEA-TECDOC-1227. XA0101549-ISVJ

