- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
- مقدمه
اخیراً استفاده از فناوری نانو در ریزپوشانی اجزای جامد، مایع یا گاز ترکیبات زیست فعال درون حاملهای کوچک به دلیل ایجاد و یژگی های منحصر به فرد از جمله رهایش با سرعتی کنترل شده تحت شرایط خاص بسیار مورد توجه قرار گرفته است. افزایش راندمان ریزپوشانی، بهبود دسترسی زیستی مادۀ ریزپوشانی شده و رهایش سریعتر و یكنواخت تر به دلیل نسبت سطح به حجم بیشتر حامل های در مقیاس نانو ایجاد میشود. روش های مختلف نانوریزپوشانی انواع مواد مؤثر مختلف مانند داروها، و یتامین ها، عصاره ها و اسانس های گیاهی از جمله هیدروژل ها، ساختارهای لیپوزومی، کامپوزیت ها و تكنیک های پیشرفته مانند پرینتر سه بعدی و فرایندهای الكتروهیدرودینامیكی تاکنون توسط محققان مختلف بررسی شده اند. فرایند الكترواسپری از فناوری های نوین در تولید نانوساختارها و نانوریزپوشانی ترکیبات فعال است. در این فرایند، محلول پلیمری از لوله مویینهای خارج و تحت میدان الكتریكی قوی باردار میشود. زمانی که نیروی الكترواستاتیک ایجادشده در محلول از کشش سطحی آن قویتر باشد، قطره سیال تولیدی در نوک لوله مویین (که به آن جت سیال گفته میشود) به سرعت به سمت صفحه جمع کننده حرکت میکند ، و طی برخورد با مولكول های هوا، حلال تبخیر میشود. بر اثر تبخیر حلال، ذرات کوچکتر میشوند، در نتیجه بار الكتریكی آنها افزایش مییابد. افزایش دانسیته بارهای الكتریكی قطره منجر به انفجار آن و تولید قطره های ریزتر میشود. از مزایای این روش ، نسبت به روش های متداول ریزپوشانی، ساده بودن فرایند، راندمان بالا و تولید نانوذرات در شرایط معمول بدون نیاز به اعمال دماهای بالا برای حذف حلال یا دمای پایین برای تشكیل ذرات است. در گذشته، ریزپوشانی برای پوشاندن طعم نامطلوب برخی از ترکیبات و همچنین برای تبدیل مواد مایع به جامد به منظور تسهیل حمل و نقل و نگهداری آنها استفاده میشد ، اما در مهر و موم های اخیر رهایش کنترل شده مكانی یا زمانی اجزای ریزپوشانی شده مورد توجه قرار گرفته است یكی از هدف های اصلی ریزپوشانی محصور کردن و جداسازی برخی از اجزا و عناصر از دیگر ترکیبات موجود در ماده غذایی و آزادسازی هدفمند و کنترل شدۀ آنها در زمان و مكان معین و با سرعت مشخص است. رهایش کنترل شده به دو صورت تأخیری و پایدار قابل اجراست .در رهایش کنترل شده ترکیبات ریزپوشانی شده در داخل ریزحامل ها محصور هستند، اما با فراهم شدن شرایط زمانی یا مكانی مناسب به سرعت و به طور کامل آزاد میشوند. در رهایش پایدار مواد محصور ریزحامل ها به یكباره آزاد نمیشوند، بلكه مكانیسم آن به گونه ای است که همواره غلظت ثابتی از ماده ریزپوشانی شده در نقطه هدف وجود داشته باشد . رهایش طعم دهنده ها مثال بارز این نوع آزادسازی است. تاکنون طیف وسیعی از پلیمرهای طبیعی و سنتزی در فرایند الكترواسپری استفاده شده است اما در کاربردهای غذایی تنها پلیمرهای ایمن شناخته شده قابل استفاده هستند. از مهمترین بیوپلیمرهای مورداستفاده به عنوان حامل در ریزپوشانی ترکیبات زیست فعال غذایی به روش الكترواسپری میتوان به پروتئینها اشاره کرد. پروتئین ها برای الكترواسپری امولسیونی بسیار مفید هستند زیرا ممكن است به دلیل ماهیت آمفی فیلیک به عنوان امولسیفایر در ریزپوشانی ترکیبات آبگریز استفاده شوند. برای حل کردن جزء آبگریز ، از روغن های زنجیره متوسط به عنوان پایه استفاده میشود و تكنیک های هوموژنیزاسیون/ سونیكاسیون برای ایجاد امولسیون روغن در آب به کار گرفته میشود. پروتئین مادۀ حامل مؤثر است. زیرا امولسیون های روغن در آب را تثبیت میکند. پودر ایزوله پروتئین شیر با استفاده از فرایندهای سالم سازی (پاستوریزاسیون)، فراپالایش (اولترافیلتراسیون)، دیافیلتراسیون، تبخیر در خأل و خشککردن افشانی (اسپری) تولید میشود که حداقل 90 درصد پروتئین دارد. دو نوع اصلی پروتئین در شیر وجود دارد، کازئین و آب پنیر، و ایزوله پروتئین شیر حاوی هر دو این هاست. ایزوله پروتئین شیر دارای نسبت مشابهی از کازئین و پروتئین است که به طور طبیعی در شیر یافت میشود (80 درصد کازئین در لخته که در جر یان انعقاد شیر تولید میشود به 20 درصد باقیمانده در آب شیر). ایزوله پروتئین شیر از دیرباز به دلیل پروتئین بالا با مقدار کم چربی و لاکتوز و داشتن شاخص های فیزیكوشیمیایی مطلوب به عنوان یک عنصر غذایی کاربردی شناخته شده است. ایزوله پروتئین شیر یک افزودنی غذایی است که در طیف وسیعی از غذاها مانند پنیر، ماست و نوشیدنی های مغذی یافت میشود. با توجه به اطلاعاتی که در حال حاضر در دسترس است، هیچ تحقیقی در مورد استفاده از ایزوله پروتئین شیر به عنوان ریزحامل و پوشانندۀ مواد حساس غذایی و دارویی نشده است. بنابراین، ما در این تحقیق به ساخت و مشخصه یابی ریز (نانو) ذرات ایزوله پروتئین شیر به روش الكترواسپری پرداختیم.
- مواد و روش ها
- مواد
ایزوله پروتئین شیر 92 (MPI) درصد از شرکت آلیندا یونان تهیه شد. تمام مواد شیمیایی از برند مرک آلمان بدون هیچگونه خالص سازی مجدد تهیه شدند.
- روش ها
- تهیه محلول الکترواسپری
محلول الكترواسپری از مخلوط کردن MPI با آب مقطر پس از تنظیم pH با محلول هیدروکسید سدیم تا 7 و حرارت دادن در دمای 50 درجه سلسیوس به مدت 30 دقیقه تهیه و پس از آن به مدت 90 ثانیه تحت تیمار فراصوت در فرکانس 24 کیلوهرتز و شدت 100 درصد یكنواخت شد.
- الکترواسپری
از دستگاه الكترواسپری تک محوره مجهز به یک منبع انرژی با ولتاژ بالا در دامنه صفر تا 30 کیلوولت ساخت شرکت فناوران نانومقیاس (تهران، ایران) استفاده شد. آند دستگاه به یک سوزن فولادی ضدزنگ با گیج 22 متصل شد و سرنگ در وضعیت افقی روی یک پمپ سرنگ دارای کنترل دیجیتالی قرار گرفت به طوری که سوزن مستقیماً به شكل عمودی و رو به قسمت جمع کننده قرار گرفت. سوزن به الكترود دارای قطبیت مثبت و منبع انرژی ولتاژ بالا متصل شد. از مخروط تیلور یک اسپری از محلول پلیمری با بار مثبت شكل گرفت که در فاصله هوایی جابه جا شد و روی جمع کننده قرار گرفت. نانوذرات تولیدی روی ورق فویل آلومینیومی یا جمع کننده انباشته میشدند. تمام آزمایش های الكترواسپری در دمای اتاق اجرا شدند و زمان اجرای هر آزمایش 30 دقیقه بود.
- تجزیه و تحلیل آماری
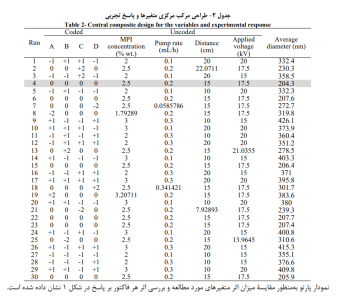
چهار متغیر اصلی طرح آماری عبارت بودند از غلظت محلول MPI ایزوله پروتئین شیر(A)، سرعت تغذیه محلول (B)، فاصله بین نوک سوزن تا جمع کننده (C)و ولتاژ اعمال شده (D) این متغیرها با سه دامنه مختلف ،1-، 0، 1+ کدگذاری شدند. مقدار آلفا (α)را می توان به عنوان فاصله محاسبه شدۀ هر نقطه محوری از مرکز در طرح RSM تعریف کرد. اگر آلفا (α)کمتر از 1 باشد نشان میدهد نقطه محوری باید یک مكعب باشد و اگر بزرگتر از 1 باشد نشان میدهد که خارج از مكعب است.
- آزمون ها
- میکروسکوپ الکترونی روبشی (SEM)
به منظور مطالعه ریزساختارهای تولیدی تصاویر از سطح1 نانوذرات با دستگاه میكروسكوپ الكترونی روبشی (تی اسكن ، جمهوری چک) تهیه شد. پیش از عكسبرداری، نمونه ها با لایه ای از طلا پوشانده و از روش رسوب دهی فیزیكی بخار (PVD) و دستگاه پوشش دهی پاششی استفاده شد. از سیستم تحلیل تصویری با شتاب ولتاژ 15 کیلوولت بهره گیری و از نمونه ها در بزرگنمایی های 20000× تصویربرداری شد.
- میکروسکوپ نیروی اتمی (AFM)
از میكروسكوپ نیروی اتمی (دی ام ای، دانمارک) دارا پروب پویشی (SPM) برای مشاهده ریزساختار نانوذرات استفاده شد. ثبت تصاویر توسط کاونده با پایه مستطیلی شكل و نوک مخروطی دارای پوشش پلاتین با نیروی ثابت 15/0-5/1 نیوتن بر متر استفاده شد. متوسط زبری و انحراف معیار پروفیل ارزیابی شده رایج ترین پارامترهای کمی برای تعیین زبری سطحی نمونه هستند که با استفاده از نرم افزار مربوط به این دستگاه محاسبه شدند.
- طیف سنجی فروسرخ با تبدیل فوریه (FTIR)
دستگاه اسپكتروفتومتر طیف سنج فروسرخ با تبدیل فوریه( بروکر، انگلستان) برای نمایش پیوند بین گروه های عملگر شیمیایی ماتریس پلیمری به کار گرفته شد. برای تعیین طیفFTIR نانوذرات، نمونهها در بین دو قرص برمید پتاسیم فشرده شدند. قرص های حاوی نمونه داخل سل دستگاه قرار گرفتند.
- نتایج و بحث
- تاثیر پارامترهای فرایندی بر قطر نانوذرات MPI
جدول 2، طراحی آزمایش و پاسخ اندازه گیری شده در هر آزمایش را نمایش میدهد.
- نتیجه گیری
با توجه به مزایای حامل های طبیعی مانند ایزوله پروتئین شیر برای مواد حساس غذایی و دارویی، ساخت و مشخصه یابی ریز (نانو) ذرات ایزوله پروتئین شیر به روش الكترواسپری در این تحقیق با موفقیت انجام پذیرفت. بر طبق نتایج مدلسازی، غلظت محلول MPI بیشترین تأثیر و فاصله بین نوک سوزن و جمع کننده کمترین تأثیر را بر قطر نانوذرات تولیدی داشتند. بر طبق نتایج به دست آمده، با بهینه سازی غلظت محلول MPI(5/2 درصد وزنی)، سرعت جریان پمپ (2/0 میلی لیتر بر ساعت) فاصله بین نوک سوزن و جمع کننده (15 سانتی متر) و ولتاژ (5/17 کیلوولت) میتوان نانوذرات یكنواخت MPI با میانگین قطر 3/204 نانومتر تولید کرد که با توجه به نتایج SEM و AFM از یكنواختی لازم برخوردار باشند. با توجه به نتایج FTIR در زمان قلیایی کردن، با افزایش pH تغییراتی در فسفات کلسیم کلوئیدی ایجاد میشود. چون در pH های بالاتر، یونیزاسیون گروه ها افزایش مییابد درنتیجه آزادی عمل گروه های کربوکسیل کمتر و به جذب قوی آن ها منجر میشود.
- منابع
- Angammana, C.J. and Jayaram, S.H. 2016. Fundamentals of electrospinning and processing technologies. Particulate Science and Technology. 34(1): 72-82.
- Araiza-Calahorra, A., Akhtar, M. and Sarkar, A. 2018. Recent advances in emulsion-based delivery approaches for curcumin: From encapsulation to bioaccessibility. Trends in Food Science & Technology. 71(1): 155-169.
- Asadi, M., Salami, M., Hajikhani, M., Emam-Djomeh, Z., Aghakhani, A. and Ghasemi, A. 2021. Electrospray production of curcumin-walnut protein nanoparticles. Food Biophysics. 16(1): 15-26.
- Baş, D. and Boyacı, I.H. 2007. Modeling and optimization I: Usability of response surface methodology. Journal of food engineering. 78(3): 836-845.
- Bezerra, M. A., Santelli, R. E., Oliveira, E. P., Villar, L. S. and Escaleira, L. A. 2008. Response surface methodology (RSM) as a tool for optimization in analytical chemistry, Talanta. 76(5): 965-977 .
- Bhushani, J. A. and Anandharamakrishnan, C. 2014. Electrospinning and electrospraying techniques: Potential food based applications. Trends in Food Science & Technology. 38(1): 21-33.
- Calamak, S. 2021. Micro/Nanoencapsulation of Active Food Compounds: Encapsulation, Characterization and Biological Fate of Encapsulated Systems. In: Sustainable Agriculture Reviews. 55(1): 93-114.
- Chen, M., Irudayaraj, J. and McMahon, D.J. 1998. Examination of full fat and reduced fat Cheddar cheese during ripening by Fourier transform infrared spectroscopy. Journal of Dairy Science. 81(11): 2791-2797.
- Coelho, S. C., Estevinho, B. N. and Rocha, F. 2021. Encapsulation in food industry with emerging electrohydrodynamic techniques: Electrospinning and electrospraying–A review. Food Chemistry. 339(1): 127850.
- Cui, W., Li, X., Zhou, S. and Weng, J. 2007. Investigation on process parameters of electrospinning system through orthogonal experimental design. Journal of applied polymer science. 103(5): 3105-3112 .
- Desai, K., Lee, J. S. and Sung, C. 2004. Nanocharacterization of electrospun nanofibers of polyaniline/poly methyl methacrylate blends using SEM, TEM and AFM. Microscopy and Microanalysis. 10(02): 556-557.
- Ekrami, A., Ghadermazi, M., Ekrami, M., Hosseini, M. A., Emam-Djomeh, Z. and Hamidi-Moghadam, R. 2022. Development and evaluation of Zhumeria majdae essential oil-loaded nanoliposome against multidrugresistant clinical pathogens causing nosocomial infection. Journal of Drug Delivery Science and Technology, 69(1): 103-148. Ekrami, M.,
- Ekrami, A., Esmaeily, R. and Emam-Djomeh, Z. 2022a. Nanotechnology-based Formulation for Alternative Medicines and Natural Products: An Introduction with Clinical Studies. Biopolymers in Nutraceuticals and Functional Foods. 545-580. Ekrami, M.,
- Ekrami, A., Moghadam, R.H., Joolaei-Ahranjani, P. and Emam-Djomeh, Z. 2022b. Food-based Polymers for Encapsulation and Delivery of Bioactive Compounds. In: Biopolymers in Nutraceuticals and Functional Foods, Royal Society of Chemistry. 488-544.
- Ekrami, M., Ekrami, A., Hosseini, M. A. and Emam-Djomeh, Z. 2022c. Characterization and optimization of salep mucilage bionanocomposite films containing Allium jesdianum Boiss. Nanoliposomes for antibacterial food packaging utilization. Molecules, 27(20): 7032. Ekrami, M., Roshani-Dehlaghi, N., Ekrami, A., Shakouri, M. and
- Emam-Djomeh, Z. 2022d. pH-Responsive Color Indicator of Saffron (Crocus sativus L.) Anthocyanin-Activated Salep Mucilage Edible Film for Real-Time Monitoring of Fish Fillet Freshness. Chemistry. 4(4): 1360-1381. Emam‐Djomeh, Z., Ekrami, M. and Ekrami, A. 2023a. Design and Use of Hydrogels for Food Component Encapsulation.
- Materials Science and Engineering in Food Product Development, 211-226. Emam‐Djomeh, Z., Ekrami, M. and Ekrami, A. 2023b. Overview of Types of Materials Used for Food Component Encapsulation.

