- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
- مقدمه
هر ساله تعداد زیادی از بیماران جان خود را بر اثر آسیب یا نقص عضو ناشی از بیماری یا تصادف از دست میدهند. یک روش معمول برای جلوگیری از عواقب ناشی از نقص عضو، پیوند عضو میباشد که سابقه ای نسبتا طولانی دارد و میتواند یک راه حل برای مقابله با مرگ بیمار بر اثر مشکل مذکور باشد، با این حال پیوند عضو همواره با مشکلاتی از قبیل محدود بودن اهداکنندگان عضو، پس زدن عضو و مشکلات ناشی از عفونت همراه بوده است و این به نوبه خود میتواند استفاده از این روش را به عنوان یک راه حل مطمئن برای درمان بیماران محدود سازد(1). مهندسی بافت به عنوان بخشی از دانش زیست فناوری، سازه های ساخت بشری را معرفی میکند که میتواند برای جایگزینی یا ترمیم بافت آسیب دیده در بشر کارآمد باشد. بر اساس آنچه که در مهندسی بافت مطرح میشود، برای ساخت یک بافت مهندسی شده، سلول ها احتیاج به یک داربست با ساختار فیزیکی دارند که امکان چسبندگی، مهاجرت، تکثیر و تمایز سلولی را برای آنها فراهم آورد تا در نهایت ماتریکس خارج سلولی در راستای ترمیم بافت آسیب دیده تشکیل شود (2). تاکنون تکنیک های مختلفی بر ساخت داربست ها تمرکز داشته اند که از جمله آن ها میتوان به خشک کردن انجمادی، خشک کردن سرمایشی امولسیونی، قالب گیری محلولی، اسفنج سازی گازی، چاپ سه بعدی و ... اشاره کرد (3). چاپ سه بعدی مجموعه فرآیندهایی میباشد که امکان تبدیل مدل های سه بعدی موجود در رایانه را به اجسام فیزیکی میدهد، این کار به صورت لایه لایه انجام میشود، درواقع با قرارگیری پی درپی لایه ها روی یکدیگر اشیاء سه بعدی شکل خواهندگرفت. چاپ سه بعدی سازه های زیست پزشکی شامل 4 مرحله اساسی میباشد که عبارت اند از: 1) تهیهی فایل دیجیتال ساختار موردنظر که عمدتا از طریق روش توموگرافی کامپیوتری و یا روش تصویربرداری با تشدید مغناطیس قابل حصول است، 2) ساخت مدل سه بعدی رایانه ای از ساختار مورد نظر توسط نرم افزار مدل سازی 3 بعدی CAD و تبدیل آن به فرمت STL تا برای چاپگر قابل خواندن باشد، 3)چاپ مدل با قرارگیری پی درپی لایه ها روی یکدیگر. این لایه ها میتواند شامل عوامل بیولوژیکی، سلول، فاکتورهای رشد و .. باشد که این مرحله به اقتضای روشهای مختلف چاپ 3 بعدی متفاوت انجام خواهدشد، 4)پس پردازش، که میتواند شامل کاشت سلول در ساختار چاپ شده باشد(4). ذکر این نکته حائز اهمیت است که بیشتر بافت های انسانی، سازه های پیچیدهی سه بعدی هستند. علاوه براین، بافت های بدن انسان ماهیت ساکن و ایستایی ندارند و قادر به بروز عملکردهای منحصر به فرد به تناسب تغییرات پویایی که در محیط بدن رخ میدهد میباشند. بنابراین رویکردهایی که تاکنون به طور معمول برای ساخت ساختارهای پیچیدهی بافت انسانی مطرح شده اند آنگونه که می بایست، کارآمد نیستند. چاپ سه بعدی نیز علاوه بر مزیت های قابل توجهی که داراست از این قاعده مستثنی نیست. علاوه بر این زنده ماندن سلول ها در این روش به علت نیروهای برشی شدیدی که به سازه وارد می آید دستخوش ضعف خواهد شد(5). چاپ چهار بعدی مفهوم گسترده شده ای از چاپ 3 بعدی میباشد که بعد زمان به عنوان بعد چهارم به آن اضافه شده است. این فناوری به ساخت سازههایی با قابلیت تغییر شکل و تغییر عملکرد در طی زمان کمک خواهدکرد و این مهم عملکرد عالی این فناوری را در عرصه ی زیست فناوری و بخصوص مهندسی بافت سبب میشود، چرا که به دنبال گسترش این فناوری ساخت سازه های هوشمند و سازگار با محیط پویای بدن ممکن خواهدشد. (6).
- اصول چاپ چهار بعدی
همان طور که در بخش مقدمه گفته شد، محدودیت هایی که چاپ 3 بعدی در زمینه زیستی دارد و عدم توانایی آن در شبیه سازی دقیق بافت زنده ی انسان، سبب ورود محققان به چاپ 4 بعدی شد. این فناوری به عنوان یک رویکرد چاره ساز در راستای مهندسی بافت و ساخت سازه هایی پویا مطرح شد و توانست سازه هایی را به دنیای زیست فناوری معرفی کند که با تغییر شکل و کاربرد به تناسب شرایط مختلف محیط درون تنی یا برون تنی، قدم مهمی در پیشرفت مهندسی بافت و دیگر زمینه های پزشکی بردارد. چاپ 4 بعدی بر مبنای اصول چاپ سه بعدی استوار است، با این تفاوت که مواد اولیه ی خاص خود را تحت عنوان مواد پاسخگو به محرک میطلبد. در واقع میتوان اینگونه بیان کرد که چاپِ 3 بعدیِ این مواد خاص، چاپ 3 بعدی را به چاپ 4 بعدی مبدل میگرداند.گسترش مواد پاسخگو به محرک قدرت پویایی و تغییرات فیزیکی و شیمیایی به تناسب محیط را به سازه های 3 بعدیِ چاپ شده میدهد؛ عموما این مواد به دلیل خواص منحصر به فردشان میتوانند توانایی (خودآرایی)، (خودتعمیری)، (حافظه شکلی)، (چندعملکردی)، (تصمیمگیری) و (حساسیت) داشته باشند. مواد پاسخگو به محرک، به محرک هایی از قبیل دما، رطوبت، میدان های الکتریکی و مغناطیسی، نور، عوامل بیولوژیکی و pH ، واکنش نشان میدهند. به علاوه چاپ 4 بعدی با کنترل شکل عالی پس از چاپ میتواند نوید بخش توانایی در ساخت داربست های با اشکال پیچیده باشد و این موضوع راه را برای ساخت داربستهای مشابه با بدن میزبان برای مقاصد ترمیم بافت و همچنین مطالعات کشت 3 بعدی هموار خواهدکرد. امکان تغییر شکل سازه پس از کاشت آن در بدن یکی دیگر از مزیت های این فناوری نوظهور میباشد که به سبب ادغام بی نقص و یکپارچهی داربست ساخته شده با ساختار هدف در بدن میزبان میتواند یک راه مناسب برای دستیابی به تهاجم کم در جراحی های مربوط به کاشت بافت در بدن باشد. مطالعات اخیر نشان داده است که پاسخ مناسب ساختارهای حاصل از چاپ 4 بعدی در محیط پویای بدن، زمینه را برای تمایز و تکثیر سلول های موجود در داربست های مذکور فراهم میآورد (7). در ادامه به بررسی انواع مواد پاسخگو به محرک و کاربرد آن ها در چاپ 4 بعدی پرداخته خواهد شد.
- پلیمرهای حافظه شکلی و مواد پاسخگو به دما
یک پلیمر حافظه شکلی قادر است که پس از قرار گرفتن در مقابل یک محرک خاص از حالت برنامه ریزی شده (شکل موقت) به حالت به خاطر سپرده (شکل اولیه) تغییر شکل دهد؛ بیشتر این پلیمرها در مقابل محرک دما کارایی نشان میدهند و از این رو به بیان سازوکار این نوع پلیمرها پرداخته میشود؛ عمل برنامه ریزی در این ساختارها در طی 4 مرحله انجام میشود: 1) بردن دما به بالاتر از دمای بحرانی پلیمر، مانند دمای انتقال شیشه، 2) ایجاد تغییر شکل با اعمال نیروی خارجی، 3)تثبیت شکل ساختار با کاهش دما و حفظ نیروی خارجی و 4)حذف نیروی خارجی. مجموع 4 مرحله گفته شده سبب آن میشود که پلیمر موردنظر به شکل موقتی که در اثر نیروی خارجی ایجاد شده درآید و در ادامه با افزایش دما به دمای بحرانی، شکل اولیه بازیابی شود (شکل 1) (8).
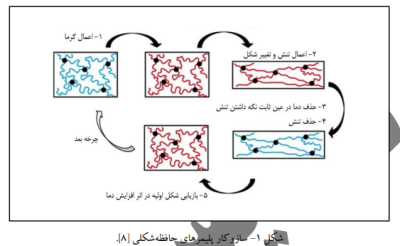
در کل مواد حافظه شکلی میتوانند در مصارف مختلف پزشکی و زیست فناوری از جمله نخ های بخیه، گیرنده های مواد دارویی، ترمیم بافت آسیب دیده و ... مورد توجه واقع شوند(9). یکی از جذابترین زمینه های کاربرد مواد حافظه شکلی استنت ها میباشد، امروزه استنت ها برای مصارف مختلف پزشکی ازجمله، باز نگهداشتن سرخرگ های کرونر پس از آنژیوپلاستی، درمان بیماری های مربوط به نای مانند تراکئوبرونکومالاسی و ... استفاده میشوند. چاپ 4 بعدی برای مبارزه با مشکلات ناشی از استنت های معمول، ازجمله شکست و یا مهاجرت استنت داخل بدن میتواند بسیار کارآمد ظاهر شود. زارک و همکارانش کامپوزیت هیدروژلی که اساس آن از جنس پلی کپرولاکتون دی متااکریلات بود را به روش استریولیتوگرافی مطابق با آناتومی نای بیمار چاپ کردند، این استنت قادر بود که در حالت موقتِ بسیار کوچکی وارد نای بیمار شود و سپس به دلیل دمای انتقال خاص خود، تحت دمای بدن بیمار (37درجه سلسیوس)، شکل دائم خود را که دقیقا منطبق بر ساختمان نای بیمار بود در طی 14 ثانیه بازیابی کند و درنهایت راه هوایی تنفس بیمار به خوبی توسط این سازه باز شود (شکل -2الف) (11). مطابق با (شکل -2ب) تلاش مشابهی توسط لیئو و همکارانش انجام شد که نتیجه آن طراحی یک کاشتنی چندلایه ی لوله ای شکل برای جلوگیری از گرفتگی رگ بود که میتوانست تحت دمای بدن مطابق با آناتومی رگ منبسط شود و راه رگ را باز کند (11). میائو و همکارانش در راستای توسعهی روشهای ترمیم اعصاب آسیب دیده ساختارهایی به نام کاندوئیت را مطرح نمودند؛ این ساختارها مجاری لوله ای شکلی از مواد طبیعی و مصنوعی اند که مانند پل ارتباطی بین دو انتهای عصب آسیب دیده قرار خواهند گرفت. کاندوئیت طراحی شده از هیبرید گرافن تشکیل شده بود و قادر به تغییر شکل از حالت صاف به حالت رول در دمای بدن بود و بدین واسطه دو سر اعصاب آسیب دیده را درخود میپیچاند؛ به علاوه اینکه کاندوئیت طراحی شده به سبب ماهیت گرافنیاش پتانسیل خیلی خوبی برای بازیابی عصب آسیب دیده و همینطور فراهم آوردن سیگنال های لازم برای تمایز سلولهای مزانشیمی موجود درساختار به سلولهای عصبی و بیان ژنهای NSE،ND1 و 2Ngn ازخود نشان داد. نهایتا طراحی این سازه ی 4 بعدی نه تنها برای ترمیم اعصاب آسیب دیده مفید واقع شد بلکه به دلیل ماهیت گرافنیاش در بازیابی اعصاب نیز کمک کننده بود (شکل -2پ) (12).
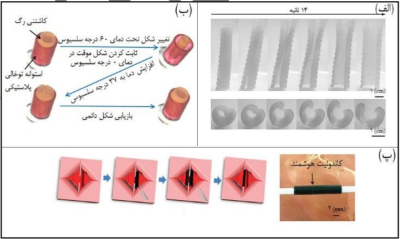
شکل -2 کاربرد مواد حافظه شکلی 4 بعدیِ چاپ شده در زیست فناوری: (الف) استنت نای (11)؛ (ب) کاشتنی چندلایه برای داخل رگ (11) و (پ) کاندوئیت برای درمان اعصاب آسیب دیده، دو قسمت سفید در عکس دو انتهای عصب هستند که از هم جدا شده اند و سازه ی سیاه کاندوئیت هیبرید گرافن میباشد که تحت دمای بدن دو انتهای عصب را در خود میپیچد (12).
باید این موضوع را همواره مدنظر قرار داد که همیشه روش های معمول چاپ برای چاپ 4 بعدی پاسخگو نیستند و گاهی باید به روش های نوین تری متوسل شد؛ به طور مثال در کار علمی گروهی از محققان عرصه ی چاپ 4 بعدی، آنها برای چاپ سازهای کامپوزیتی از پلی کاپرولاکتون تریول که از قضا خواص حافظه شکلی فوق العاده ای نیز دارد به پلیلاکتیکاسید به عنوان اسکلت فداشونده متوسل شدند و با این شیوه که در (شکل3) تشریح شده قادر به چاپ داربست ترموستی شدند که با روش معمول مدل سازی ته نشینی گداخته قادر به چاپ آن نبودند. ذکر این نکته خالی از اهمیت نیست که این داربست متخلخل با تخلخل های مناسب و به هم پیوسته نه تنها به دلیل خاصیت حافظه شکلی خود قادر است در محل آسیب دیده بصورت دقیق و با کمترین تهاجم قرار بگیرد، بلکه با تخلخل های متناسبش راه را برای رگزایی، تغذیه و دفع مواد زاید هموار میکند (13).
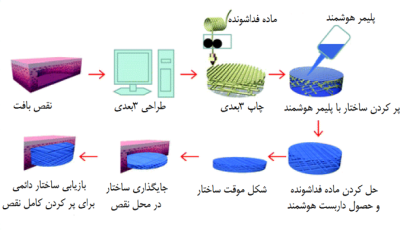
شکل 3 - چاپ 4 بعدی داربست متخلخل پایه پلی کاپرولاکتون تریول با استفاده از اسکلت فداشونده(13).
- مواد پاسخگو به رطوبت
دانشمندان بسیاری تاکنون از پتانسیل فزاینده ی مواد پاسخگو به رطوبت و سیالات استفاده کرده اند؛ از جمله جذابترین کارهایی که انجام شده است، استفاده از قابلیت این مواد برای چاپ ساختارهای حاوی سلول با هندسهی بسیار پیچیده می باشد، این ساختارها قادرند که بصورت بسیار ساده و صاف چاپ شوند و پس از چاپ و غوطهوری در سیال به صورت هوشمندی به ساختارهای پیچیده و از پیش مهندسی شده ای تغییر شکل دهند و به این دلیل چاپ این دسته از مواد در ردهی چاپ 4 بعدی جای میگیرند. بنابراین آنچه گفته شد توجهات بسیار ویژه ای را در زمینههای مختلف زیست فناوری معطوف خود ساخته است که در ادامه به ذکر چندین مورد پرداخته خواهدشد(14). به طور مثال، محیط های کشت 2 بعدی معمول در پتری دیش برای مقاصد پزشکی، بطور مثال سرطان شناسی، مناسب نیستند و بهتر است تدابیری در این رابطه اندیشیده شود. یک راه حل، کشت 3 بعدی سلول ها توسط داربست ها میباشد، اما توجه به این نکته ضروریست که طراحی و ساخت یک داربست حاوی سلول زنده مطابق با آناتومی مورد نظر کار چندان راحتی نمی باشد و عموما روش های شناخته شده به مرگ سلول های محبوس در پیش ماده منجر میشوند؛ چاپ 4 بعدی مواد پاسخگو به رطوبت به صورت بالقوه ای به حل این مشکل کمک کرده است. برای مثال کوانگ و همکارانش متوجه شدند که برای مطالعه ی سرطان کارسینوم تهاجمی مجرایی شبیه سازی آسینی و مجاری پستان تاثیر شگرفی در نتایج تحقیقات دارد و برای حصول بهتر و ساده تر به این هدف، به مواد پاسخگو به رطوبت متوسل شدند. این سازهی پاسخگو به سیال از دولایه پلی اتیلن گلیکول دیاکریلات و کو پلیمریزه ی (متااکریلات ژلاتین و پلیاتیلنگلیکول دیاکریلات) -که سلول های MDA-MB-231 در این لایه دوم محبوس شده بود تشکیل شد. داربست تهیه شده بصورت ساده و بی هیچ پیچیدگی بود اما پس از غوطه وری در محیط کشت یا یک سیال، خود به خود به ساختار لولهای شکلی برای شبیه سازی مجاری پستان تغییر فرم یافت که این تغییر شکلِ خاص نتیجهی نرخ تورم متفاوت دو لایه بود (15). یکی از چالش های فناوری چاپ 3 بعدی، تولید ساختارهای لولهای توخالی باقطر داخلی بسیار اندک، میباشد، بنابراین این فناوری در ساخت سازه های کانال طور به مانند رگ های خونی و کانال های هاورس ضعیف و ناتوان عمل میکند و اینجاست که چاپ 4 بعدی میتواند به عنوان یک راه حل مشکل گشا عمل کند؛ همانطور که کریلووا یک کامپوزیت هیدروژلی پایه هیالورونیک اسید که توسط نور سبز شبکه ای میشود را بصورت لایه لایه چاپ نمود. این ساختار در مواجهه با سیال آب یا محیط کشت به علت وجودگرادیان شبکهای شدن، به ساختار لولهای خم میشود و نهایتا منجر به ساختاری با قطر داخلی بسیار کوچکی به اندازهی 21 میکرومتر میگردد (شکل 4) (16).
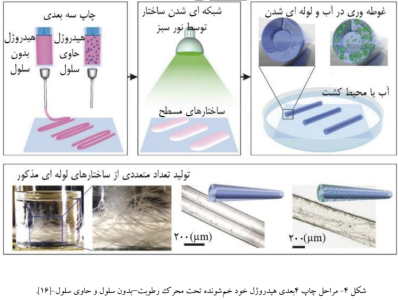
- مواد پاسخگو به میدان مغناطیسی
شاید بتوان گفت که عمده
ترین کاربرد ساختارهای 4 بعدی، در زمینهی سازه های پاسخگو به میدان مغناطیسی است. ژل های پاسخگو به میدان مغناطیسی از نانوذرات مغناطیسیِ پراکنده شده در یک شبکهی پلیمری تشکیل شده اند. میدان مغناطیسی خارجی بر سازه های متشکل از این مواد اثرگذار است و سبب تغییرات محسوسی در آنها میشود، به عنوان مثال میتواند خواص مکانیکی آنها را دستخوش تغییر کند. از مزایای این ساختارها این است که میدان مغناطیسی میتواند بصورت موضعی و همچنین از راه دور عمل کند و تاثیر گذار باشد. همچنین مطالعاتی انجام شده که نشان میدهد میدان مغناطیسی میتواند بر عملکرد سلول ها و مواد محبوس در ساختار اثرگذار باشد، به طور مثال فاکتورهای رشد میتوانند در هیدروژلهای پاسخگو به مغناطیس محبوس شوند و تحویل آنها توسط اعمال میدان مغناطیسی خروجی کنترل شود (17). بسیاری از سیستم های بیولوژیکی بدن دارای ساختارهای ناهمسان گردی هستند که به معنای جهت گیری اجزای تشکیل دهنده در راستایی خاص است. یکی از پیشنهادات جذاب و کارآمد دانشمندان برای ساخت این ساختارها استفاده از مواد پاسخگو به مغناطیس است و قطعا استفاده از این مواد در فناوری چاپ 4 بعدی میتواند به نتایح شگرفی منتهی شود، همانطور که گروهی از محققان از چاپ 4 بعدی برای تولید ساختاری غضروف مانند استفاده نمودهاند. غضروف به تناسب جهت گیری فیبرهای کالژن دارای سه قسمتِ لایهی سطحی، لایهی میانی و لایهی عمقی است که فیبرهای کالژن در این سه لایه به ترتیب با جهت گیریِ به موازات مفصل، رندوم و عمود به مفصل قرار دارند. ساختاری که از آن یاد شد در قرنیه ی چشم و همچنین پالپ دندانی نیز مشاهده شده است (شکل -5 الف). گروه تحقیقاتی مذکور موفق به چاپ نمونه ی سه لایهای متشابه غضروف شدند، و حصول این مهم با چاپ 4 بعدی ممکن شد؛ بدین ترتیب که پیش مادهی لازم برای چاپ که از آگاروز و کالژن نوع I تشکیل شده بود را با نانوذرات مغناطیسی آهنی که با استرپتاویدین پوشش داده شده بودند. به علت جلوگیری از کاهش زیست سازگاری ترکیب نمودند و این مجموعه جوهر چاپ 4 بعدی را تشکیل داد؛ پس از چاپ، این سازهی 4 بعدی در برابر اعمال میدان مغناطیسی واکنش داد و جهت گیری فیبرهای کالژن در لایه های مورد نظر به علت وجود ذرات مغناطیسی ممکن شد (شکل -5ب). همچنین این گروه محققان دریافتند که اگر در سازهی فوق سلول های کندروسیت محبوس شوند، در صورت وجود شرایط لازم، بیان کالژن نوع I و کالژن نوع II در مقایسه با همتای این سازه که دارای فیبرهای جهت نیافته است، افزایش خواهدیافت (18).
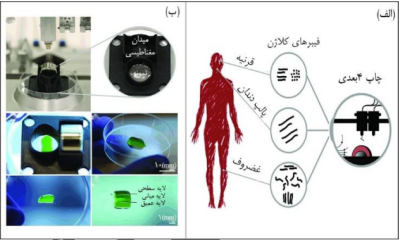
شکل -5 الف) نمایش ساختار ناهمسانگرد فیبرهای کالژن در قرنیه، پالپ دندان و مفصل غضروفی؛ ب)چاپ ساختار سه لایه متشابه مفصل غضروفی به کمک نانوذرات پاسخگو به مغناطیس و با اعمال میدان مغناطیسی (18).
- مواد پاسخگو به pH
مواد پاسخگو به اسیدیته گروهی دیگر از مواد پاسخگو به محرک میباشند که در برابر تغییرات pH بصورت تغییر هوشمندانه ی ساختار و یا ویژگی هایشان واکنش نشان میدهند. قدرتِ حساسیت به pH توانسته نوید بخش طراحی ساختارها و داربست هایی باشد که به اسیدیته ی عفونت زخم ها واکنش نشان میدهند و سبب رهایش هوشمند دارو و آنتی بیوتیک ها در محل زخم میشوند. درواقع، با تغییرات pH، این ساختارها میتوانند دستخوش تغییراتی بصورت تورم و یا جمع شوندگی بشوند. به طور مثال اگر یک هیدروژل در یک محیط اسیدی یونیزه و دارای بار مثبت شود، برای برقراری تعادل در بار الکتریکی، آنیون ها از محلول خارجی وارد هیدروژل خواهند شد، و با افزایش غلظت آنیون ها فشار اسمزی افزایش پیدا خواهد کرد و بنابراین هیدروژل متورم خواهدشد -تعادل گیبس دونان-. بنابراین این مواد از پتانسیل بالایی برای استفاده در چاپ 4 بعدی برخوردارند (19). سلول های سرطانی به دنبال مصرف زیاد گلوکز و تولید لاکتیک اسید یک محیط اسیدی را اطراف خود رقم میزنند، خاصیت منحصر به فرد هیدروژل های پاسخگو به pH ، جذابیت زیادی را برای استفاده از آنها در راستای دارورسانی هوشمند داروهای ضدسرطان ایجاد کردهاست، به نحوی که حامل های دارو قادرند در مواجهه با محیط اسیدی اطراف تومور به آزاد کردن دارو بپردازند. در این راستا، سانگ یک داربست هسته پوستهی حساس به pH را طراحی نمود تا با هدف جلوگیری از عود سرطان پس از برداشتن تومور، در محل قبلی تومور کاشته شود؛ داربست ساخته شده از پوستهای با ترکیب ژلاتین و بیکربنات سدیم به منظور ایجاد حساسیت دربرابر -pH متشکل شده بود که داروی ضدالتهابِ سیپروفلوکساسین بر سطح آن قرار گرفتهبود، هستهی این ساختار هم شامل پلی(لاکتید-کو-کپرولاکتون) و داروی شیمی درمانی دوکسورابیسین هیدروکلراید بود؛ تحقیقات برون تنی بر روی این سازه به خوبی نشان داد که با اسیدی شدن محیط که به دنبال رشد دوبارهی تومور محتمل است، رهایش دارو توسط این داربست شروع میشود ، بنابراین این ایده ی جالب میتواند چراغ راه دانشمندانی باشد که در راه توسعه ی چاپ 4 بعدی در زمینهی دارورسانی با سیستم های کاشتنی فعالیت میکنند(شکل 61)(20).
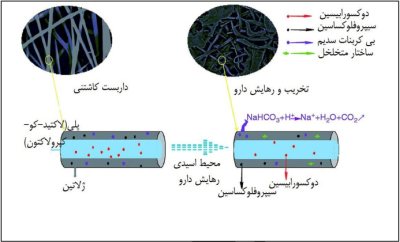
شکل 6- طراحی داربستِ هسته-پوسته ی حساس به pH محیط اسیدی تومور برای رهایش داروهای شیمی درمانی بر اثر عود مجدد بیماری(21).
- مواد پاسخگو به نور
ژل های پاسخگو به نور، موادی هستند که قادرند در مقابل تابش نور ویژگی های فیزیکی و شیمیایی خود را مانند الاستیسیته، گرانروی، شکل و درجه تورم تغییر دهند و همین آنها را به موادی جذاب برای کابردهای زیست پزشکی مبدل کرده است. اینکه یک سیستم با مواد پاسخگو به نور آمیخته شود میتواند پتانسیل های زیادی برای آن سیستم رقم بزند. از جمله ی این جذابیت ها میتوان به عدم لزوم تماس منبع نور با سازه، ارزان و زیست سازگار بودن محرک، قابلیت کنترل فضایی بر تغییرات ساختار که به راحتی با تغییر جهت نور ممکن خواهد بود و حذف سریع و راحت محرک، اشاره کرد. مزیت های مذکور، سازه های حساس به نور را شایسته ی استفاده و کاربرد در زمینه های مختلفی میکند. یک هیدروژلِ کاشتنی پاسخگو به نور میتواند ساختاری پویا و مفید را جهت پیشرفت مهندسی بافت ارائه دهد. از جمله کاربردهایی که برای سازه های حساس به نور ذکر شده، تخریب مواد زیستی به واسطه ی نور میباشد(21). در این راستا کلاکسین یک داربست تخریب پذیر با نور، از هیدروژلِ پایه پلیاتیلنگلیکول را طراحی نمود که حاوی کانالهای متصل به یکدیگر بود، سلول های محبوس در داربست به دنبال تخریب کانالها به دلیل تابشِ نور، امکان انتقال و مهاجرت درون داربست را پیدا نمودند، بنابراین چنین ساختاری اجازهی کنترل بر رفتار و حرکت سلول ها را در داربست فراهم میآورد (22). ترکیب حساسیت به نور و دیگر محرک ها در ساختار میتواند آنها را برای کاربردهای زیستفناوری مستعدتر سازد. کوی و همکارانش سازهی نانوکامپوزیتیِ حساس به نور فروسرخ را با روش چاپ 4 بعدی تولید نمودند، خواص این سازه مخلوطی از خاصیت نورگرمایی گرافن و خاصیت حافظه شکلی اپوکسی بود؛ ساختار چاپشده قادر است تا تحت دمای بالاتر از دمای شیشه ای اپوکسی و اعمال نیروی خارجی به ساختار موردنظر تغییرشکل بدهد و با حذف دما و نیرو در شکل موقت تثبیت شود، مزیت چنین ساختاری این است که با تابش نور فروسرخِ با لیزر و به دنبال تبدیل فوتون های نور به گرما توسط گرافن، میتوان بصورت کنترل شده و انتخابی ساختار دائم و اولیه را بازیابی نمود. چنین ساختاری برای کاربردهای پزشکی و زیستفناوری از پتانسیل بالایی برخوردار است و میتواند برای جراحیهای کم تهاجمی مفید واقع شود و از آنجا که پرتوهای استفاده شده در این روش برای بدن مضر نیستند میتواند به عنوان روشی ایمن تلقی گردد. همچنین این گروه تحقیقاتی دریافتند که ساختارهای این چنینی از پتانسیل خوبی برای محصور کردن سلول ها و همچنین کاشتن در بدن برخوردارند (23).
- مواد پاسخگو به میدان الکتریکی
هیدروژل های پاسخگو به الکتریسیته نیز قادرند کارایی و شکل خود را تحت تاثیر میدان الکتریکی تغییر دهند، از آنجا که قدرت تنظیم سیگنال های الکتریکی و همینطور جهت گیریِ اعمالِ میدان امکانپذیر است، بنابراین میتوان بر میزان واکنش ساختارهای پاسخگو کنترل شایستهای داشت. این ساختارها از کاربرد وسیعی در سیستم های دارورسانی، میکروپمپ ها و ساختارهای مهندسی شده برای جایگزینی در بافت برخوردارند. تحقیقات نشان داده که سیگنال های الکتریکی تاثیر باالقوهای بر فعال شدن مسیرهای سیگنالینگ دارند و به طور مثال خواهند توانست بر مهاجرت، رشد و تمایز سلولی، تاثیر بگذارند و بنابراین سازه های پاسخگو به میدان الکتریکی در نقشِ داربستهای حاوی سلول بسیار کارآمد ظاهر خواهند شد؛ حال آنکه اگر داربست مذکور از ویژگی هایی چون زیست سازگاری نیز برخوردار باشد خواهد توانست قدم های محکم و به سزایی را در راستای پیشرفت مهندسی بافت بردارد. از آنجا که مواد هادی جریان الکتریسیته در زمینهی خواص مکانیکی از محدودیتها و کاستی هایی برخوردارند، استفاده از نانوکامپوزیت های هادی دارای ارجحیت خواهد بود، این نانوکامپوزیت ها عمدتا از نانوذرات هادی در یک زمینه ی پلیمری تشیکل شده اند (24). سروانت نشان داد که صفحات گرافن گنجانده شده در یک هیدروژلِ ماکرو متخلخل قابلیت زیادی را برای استفاده به عنوانِ یک داربستِ فعالِ الکتریکی داراست، حال آنکه این داربست میتواند حاوی دارو نیز باشد و پس از کاشته شدن در بدن، تحت اعمال ولتاژ الکتریکی و به دنبالِ منقبض و جمع شدنِ هیدروژل، اقدام به رهایش دارو بکند. از مزیت های این ساختار میتوان به کنترل رهایش اشاره کرد که به اقتضای شرایط موجود در بدن به داربست کاشته شده این اجازه داده میشود تا با اعمال میدان الکتریکی، دارو را آزاد کند، به علاوه افزودن گرافن به ساختار نه تنها خواص مکانیکی ساختار را بهبود میبخشد بلکه سبب حذف گرمایشِ حاصل از عبور میدانِ الکتریکی از سازه نیز میشود (25). همچنین ساختارهای این چنینی برای تمایز سلول های بنیادی به سلول های عصبی نیز کاربرد دارند که رحمانی و همکاران بر این مهم تحقیق نموده اند و نشان دادند که داربست 3 بعدی متشکل از سیلک فیبروئین و اکسید گرافن کاهش یافته در تمایز سلول های بنیادی به سلول های عصبی در پیِ اعمال پالس های الکتریکی، نقش بسزایی دارد (26). بنابراین مواد پاسخگو به میدان الکتریکی به دلیل پویایی که در ساختار ایجاد می نمایند، از قابلیت بالایی برای گسترش چاپ 4 بعدی برخوردارند.
- نتیجه گیری
چاپ زیستی 4 بعدی به عنوان یک فناوری نوظهور به پیشرفت و توسعه ی زیست فناوری، بخصوص مهندسی بافت کمک شایانی نموده است. این روش نه تنها به سازه های کاشتنی منجر میشود که با حداقل تهاجم در بدن کاشته میشوند، بلکه در راستای بهبود و توسعه ی کشت 3 بعدی نیز قدم برمیدارد. همچنین داربست های طراحی شده بدین روش در جهت محبوس کردن دارو نیز کارایی دارند. با وجود اینکه چاپ 4 بعدی از مزیت های فراوانی برخوردار است، اما این فناوری بسیار نوظهور است و همچنان احتیاج به تحقیق و بررسی دارد و باید راه بسیاری پیموده شود تا به بلوغ و تکامل لازم برسد. همچنین امکان دارد ما با پیش مادهی پاسخگو به محرکی مواجه باشیم که قابلیت چاپ نداشته باشد و این موضوع طبعا مسیر ساخت را دچار چالش میکند. به علاوه در بدن انسان شرایط پیچیدهای وجود دارد که هر آن امکان بروز تغییرات در آن وجود دارد و سازهی چاپ شده باید قادر باشد تا به این شرایط پیچیده پاسخی درخور دهد و طبیعتا سازه های 4 بعدی مطرح شده که در ابتدای راه هستند، احتیاج به بررسی و تغییرات بیشتری دارند.
- منابع
- Lee K.Y. and Mooney D.J., Hydrogels for tissue engineering, CHEM REV, 101, 1869- 1880, 2001
- Carvalho J.L., de Carvalho P.H., Gomes D.A. and de Goes A.M., Innovative strategies for tissue engineering, ADV BIOMAT, 11, 295, 2013
- Eltom A., Zhong G. and Muhammad A., Scaffold techniques and designs in tissue engineering functions and purposes: a review, ADV MATER SCI ENG, 2019, 2019
- Ventola C.L, Medical applications for 3D printing: current and projected uses, Pharmacy and Therapeutics, 39, 704, 2014
- Lui Y.S., Sow W.T., Tan L.P., Wu Y., Lai Y. and Li H., 4D printing and stimuliresponsive materials in biomedical aspects, ACTA BIOMATER, 92, 19-36, 2019
- Shafranek R.T., Shafranek R.T., Millik S.C., Smith P.T., Lee C.U., Boydston A.J. and Nelson A., Stimuli-responsive materials in additive manufacturing, PROG POLYM SCI, 93, 36-67, 2019
- Morouço P., Lattanzi W. and Alves N., Four-dimensional bioprinting as a new era for tissue engineering and regenerative medicine, Frontiers in Bioengineering and Biotechnology, 61, 2017
- Hasan S.M., Nash L.D. and Maitland D.J., Porous shape memory polymers: Design and applications, J POLYM SCI POL PHYS, 54, 1300-1318, 2016
- Liu C., Qin H. and Mather P., Review of progress in shape-memory polymers, J MATER CHEM, 17, 1543-1558, 2007
- Zarek M., Mansour N., Shapira S. and Cohn D., 4D printing of shape memory‐based personalized endoluminal medical devices, MACROMOL RAPID COMM, 38, 1600628, 2017
- Liu D., Xiang T., Gong T., Tian T., Liu X. and Zhou S., Bioinspired 3D multilayered shape memory scaffold with a hierarchically changeable micropatterned surface for efficient vascularization, ACS APPL MATER INTER, 9, 19725-19735, 2017
- Miao S., Cui H., Nowicki M., Xia L., Zhou X., Lee S.J., Zhu W., et al, Stereolithographic 4D bioprinting of multiresponsive architectures for neural engineering, Advanced biosystems, 2, 1800101, 2018
- Miao S., Zhu W., Castro N.J., Leng J. and Zhang L.G., Four-dimensional printing hierarchy scaffolds with highly biocompatible smart polymers for tissue engineering applications, TISSUE ENG PART C-ME, 22, 952-963, 2016
- Joseph J.S., Malindisa S.T. and Ntwasa M., Two-dimensional (2D) and threedimensional (3D) cell culturing in drug discovery, Cell Culture, 2, 1-22, 2018
- Kwag H.R., Serbo J.V., Korangath P., Sukumar S., Romer L.H. and Gracias D.H., A selffolding hydrogel in vitro model for ductal carcinoma, TISSUE ENG PART C-ME, 22, 398-407, 2016
- Kirillova A., Maxson R., Stoychev G., Gomillion C.T. and Ionov L., 4D biofabrication using shape‐morphing hydrogels, ADV MATER, 29, 1703443, 2017
- Ilg P., Stimuli-responsive hydrogels cross-linked by magnetic nanoparticles, Soft Matter, 9, 3465-3468, 2013
- Betsch M., Cristian C., Lin Y.Y., Blaeser A., Schöneberg J., Vogt M., Buhl E.M. et al., Incorporating 4D into bioprinting: real‐time magnetically directed collagen fiber alignment for generating complex multilayered tissues, ADV HEALTHC MATER, 7, 1800894, 2018
- Traitel T. and Kost J., pH-responsive hydrogels: Swelling model in Biomaterials, From Molecules to Engineered Tissue, 29-43, 2004
- Sang Q., Li H., Williams G., Wu H. and Zhu, L.M., Core-shell poly (lactide-co-εcaprolactone)-gelatin fiber scaffolds as pH-sensitive drug delivery systems, J BIOMATER APPL, 32, 1105-1118, 2018
- Li L., Scheiger J.M. and Levkin P.A., Design and applications of photoresponsive hydrogels, ADV MATER, 31, 1807333, 2019
- Kloxin A.M., Kasko A.M., Salinas C.N. and Anseth K.S., Photodegradable hydrogels for dynamic tuning of physical and chemical properties, Science, 324, 59-63, 2009
- Cui H., Miao S., Esworthy T., Lee S.J., Zhou X., Hann S.Y., Webster T.J. et al., A novel near-infrared light responsive 4D printed nanoarchitecture with dynamically and remotely controllable transformation, NANO RES, 12, 1381-1388, 2019
- Shi Q., Liu H., Tang D., Li Y., Li X. and Xu F., Bioactuators based on stimulusresponsive hydrogels and their emerging biomedical applications, NPG ASIA MATER, 11, 64, 2019
- Servant A., Leon V., Jasim D., Methven L., Limousin P., Fernandez‐Pacheco E.V., Prato M. et al., Graphene‐based electroresponsive scaffolds as polymeric implants for on‐demand drug delivery, ADV HEALTHC MATER, 3, 1334-1343, 2014
- Rahmani A., Nadri S., Kazemi H.S., Mortazavi Y. and Sojoodi M., Conductive electrospun scaffolds with electrical stimulation for neural differentiation of conjunctiva mesenchymal stem cells, ARTIF ORGANS, 43, 780-790, 2019

