
Blog
بایوسنسور

بیوسنسور چیست؟ | هر آنچه باید در مورد حسگرهای زیستی بدانید
حسگر زیستی یا بیو سنسور (Biosensor) نام گروهی از حسگرها است که به گونه ای طراحی شده اند تا بتوانند تنها با یک ماده خاص واکنش نشان دهند .نتیجه این واکنش به صورت پیام هایی در میآید که یک ریزپردازنده میتواند آن ها را تحلیل کند. این حسگرها مختلفند اما جدای از نوعشان، همگی دارای ساز و کاری مشترک اند و در مسیر سال های اخیر پیشرفت های زیادی در عرصه های گوناگون داشته اند. طبق تعریف اتحادیه بین المللی شیمی کاربردی و اتحادیه بین المللی شیمی محض (IUPAC)،حسگر زیستی عبارت است از مجموعه ابزارهایی که با استفاده از واکنش های بیوشیمیایی خاصی، به واسطه آنزیم های ایزوله، بافت ها، سلول ها یا هر عنصر شیمیایی ماده مورد نظر را معمولاً به صورت الکتریکی، اُپتیکی یا گرمایی آشکارسازی میکند. حسگرهای زیستی معمولاً برای به دست آوردن غلظت محلولی (گلوکز خون) و بررسی دی ان ای (DNA) به منظور کشف هرگونه نقص ژنتیکی یا ابتلاء به سرطان ها در بدو تولد بکار میروند.
برای کشف این گونه اختلالات، در این روش با مقایسه طیف دی ان ای با طیف ناشی از دی ان ای دارای نقص در ترتیب که منجر به ایجاد سرطان میشود، از بدو تولد میتوان از ابتلاء به سرطان یا سایر بیماری های ژنتیکی اطلاع یافت. حواس بویایی و چشایی انسان که به شناسایی بوها و طعم های مختلف میپردازد یا سیستم ایمنی بدن که میلیون ها نوع مولکول مختلف را شناسایی میکند، نمونه هایی از حسگرهای زیستی طبیعی هستند.

عملکرد بیوسنسور و انواع آن
نخستین بار مفهوم حسگرهای زیستی، توسط دکتر لیلاند سی. کلارک ( Dr. Leland C. Clark ) در اوایل سال های 1960 با استفاده از آنزیم الکترود ( Enzyme Electrode ) برای اندازه گیری غلظت گلوکز، برای بیماران دیابتی؛ توسط آنزیم گلوکز اکسیداز ( Oxidase ) معرفی شد. امروزه نیز بیشترین کاربرد حسگرهای زیستی، در زمینه اندازهگیری گلوکوز است اما با پیشرفت هایی که در زمینه میکروالکتریک و میکرومکانیک (Micromechanics) رخ داده ، تمرکز زیادی بر روی سیستم های مبتنی بر این دو قرار گرفته است، گاهی تعداد حسگرها به بیش از 1000 عدد بر سانتی متر مربع میرسد. با توجه به دقیق بودن اینگونه ابزارها، انتخاب مبدل مناسب و روش مناسب تثبیت دریافت گر زیستی در سطح جامد، موجب افزایش حساسیت و پایداری آن میگردد.
توسعه حسگرهای زیستی از سال 1962 و با ساخت الکترود اکسیژن توسط کلارک در سین سیناتی آمریکا، برای اندازهگیری غلظت اکسیژن حل شده در خون آغاز شد. این حسگر هم چنین به نام سازنده آن گاهی الکترود کلارک نیز خوانده می شود. بعداً با پوشاندن سطح الکترود با آنزیمی که به اکسیده شدن گلوکز کمک میکرد، از این حسگر برای اندازهگیری قند خون استفاده شد. به طور مشابه با پوشاندن الکترود توسط آنزیمی که قابلیت تبدیل اوره به کربنات آمونیوم را داراست در کنار الکترودی از جنس یون ان اچ فور پلاس (NH4 + ) ،حسگری ساخته شد که میتوانست میزان اوره در خون یا ادرار را اندازهگیری کند. این دو حسگر زیستی از مبدل های متفاوتی در بخش تبدیل سیگنال
استفاده میکردند به طوری که در نوع اول میزان قند خون با اندازهگیری جریان الکتریکی (آمپرومتریک) (Amperometric ) تولید شده اندازهگیری میشد و در نوع دوم اندازهگیری غلظت اوره بر اساس میزان بار الکتریکی (پتانسیومتریک) (Potentiometeric) ایجاد شده در الکترودها صورت میپذیرفت.
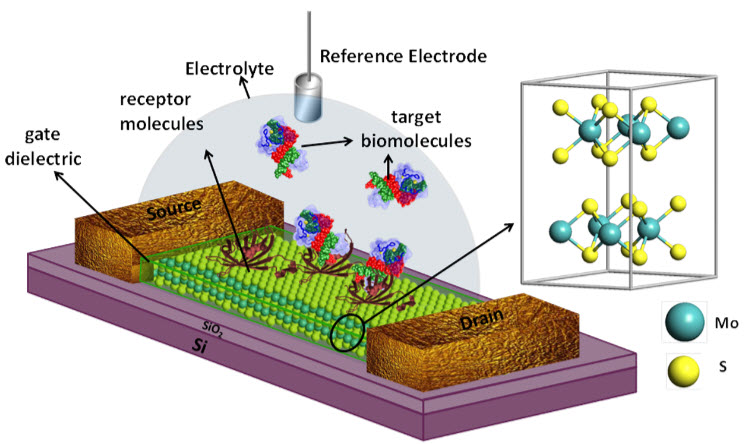
حسگرهای زیستی انواع مختلفی دارند؛ اما جدای از نوعشان، همگی دارای عملکرد یکسانی می باشند. هر حسگر زیستی . شامل دو بخش اصلی است: بخش نخست، عنصر تشخیص دهنده (Recognition Element) است که برقراری پیوند شیمیایی با هدف را توسط لیگاند (Ligand) )میسر میسازد و دومین بخش، انتقال دهنده (Transducer) نام دارد. وظیفه این بخش تبدیل سیگنال های دریافت شده است. حسگرهای زیستی دارای دو نوع اساسی حسگر های مستقیم و غیرمستقیم اند.
در حسگرهای زیستی مستقیم، هدف بدون هیچ واسطه ای با لیگاند پیوند برقرار کرده و شناسایی میشود. اما در حسگر غیرمستقیم، این کار توسط یک عنصر واسطه انجام میگیرد. سرعت و سادگی حسگرهای مستقیم نسبت به غیرمستقیم بیشتر است. قابلیت استفاده در حالت غیرمستقیم و اندازهگیری تغییرات فیزیکی (خواص اپتیکی، الکتریکی و شیمیایی) از دیگر کاربردها و مزایای نوع مستقیم آن است. عملکرد حسگرهای زیستی نیز به دو نوع دیگر اپتیکی و مکانیکی بخش بندی می شود، از انواع اپتیکی آن می توان به اس پی آر یا تشدید کننده پلاسمون سطحی.
اساس بیوسنسور
یک گروه از سیستم های اندازه گیری می باشند و طراحی آنها بر مبنای شناسایی انتخابی آنالیتها بر اساس اجزا بیولوژیک و آشکارسازهای فیزیکی و شیمیایی صورت می پذیرد. یک بیوسنسور در حقیقت شامل یک حسگر کوچک و ماده بیولوژیک تثبیت شده بر آن می باشد. بیوسنسور ها ابزارهای آنالیتیکی بشمار می روند که می توانند با بهره گیری از هوشمندی مواد بیولوژیک، ترکیب یا ترکیباتی را شناسایی نموده ، با آنها واکنش دهند. و بدین ترتیب یک پیام شیمیایی، نوری و یا الکتریکی ایجاد نمایند.
فناوری بیوسنسور
فناوری بیوسنسور در حقیقت نشان دهنده ترکیبی از علوم بیوشیمی، بیولوژی مولکولی، شیمی، فیزیک، الکترونیک و کامپیوتر است. از آنجا که بیوسنسورها ابزاری توانمند جهت شناسایی مولکول های زیستی می باشند، امروزه از آنها در علوم مختلف پزشکی، صنایع شیمیایی، صنایع غذایی، مانیتورینگ محیط زیست ، تولید محصولات دارویی، بهداشتی و غیره بهره می گیرند.
بیشترین کاربرد بیوسنسور ها در تشخیص های پزشکی و علوم آزمایشگاهی است.
مزایای بیوسنسور
مزایای بیوسنسور ها بر سایر سیستمهای اندازه گیری موجود استفاده آسان، اغلب بدون نیاز به متخصص، هزینه کم، حساسیت و دقت بالا، انتخاب گری و اختصاصیت عمل بالا عدم نیاز به وسایل پیشرفته و صرف زمان و هزینه زیاد برای تشخیص آنالیت ها در مراکز کوچک و در مراکز با امکانات کم و حتی در منزل نیز کاربرد دارد.
عناصر بیولوژیکی عامل اصلی گزینش در بیوسنسورها محسوب می شوند که عمدتا در چهار گروه تقسیم بندی میگردندکه به شرح زیر می باشد:
- آنتی بادی
2.آنزیم
3.اسید آمینه - ساختار های سلولی/ سلول ها
بیوسنسور ها بر اساس نحوه شناسایی آنالیت به دو گروه عمده تقسیم می گردند:
- بیوسنسورها با اساس شناسایی مستقیم آنتی ژن: که واکنش پذیرنده با آنالیت مستقیما توسط سنسور شناسایی می گردد. عناصر بیولوژیک مورد استفاده در این گروه ، گیرنده های سلولی و آنتی بادی ها می باشند.
- بیوسنسورها با اساس شناسایی غیر مستقیم آنتی ژن: واکنش پذیرنده با آنالیت به طور غیر مستقیم توسط سنسور شناسایی می گردد. عناصر بیولوژیک مورد استفاده در این گروه ترکیبات نشاندار، مثل آنتی بادیها ی نشاندار شده و یا ترکیباتی با خاصیت کاتالیتیکی مانند آنزیم ها می باشند
۲.روش های تثبیت اجزای بیولوژیکی:
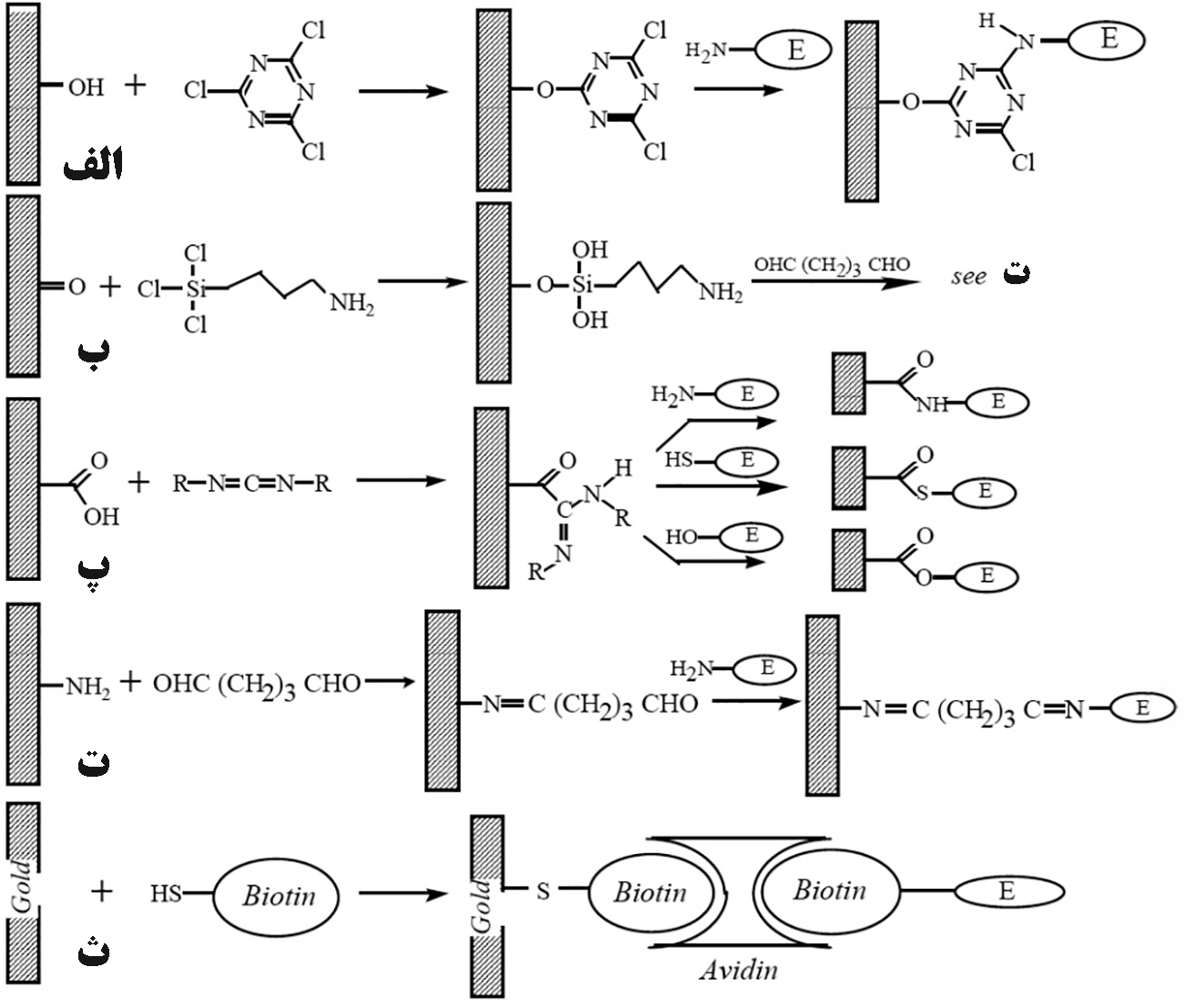
به منظور ساخت یک بیوسنسور پایدار،باید جزء بیولوژیکی به طرز خاصی به مبدل ها متصل گردد، چنین فرآیندی را تثبیت گویند. برای این منظور پنج روش به شرح زیر ارائه شده است:
- جذب سطحی
- ریزپوشینه سازی
- محبوس سازی
- پیوند عرضی
- پیوند کووالانسی
مبدل:
مبدل، تغییر قابل مشاهده فیزیکی یا شیمیایی را به یک پیغام قابل اندازه گیری، که بزرگی آن متناسب با غلظت ماده یا گروهی از مواد مورد سنجش است، تبدیل می نماید، چنین عملی ازتلفیق دو فرایند متفاوت حاصل می شود؛ این وسیله ویژگی و حساسیت مواد بیولوژیکی را با قدرت محاسبه گری ریزپردازشگر ترکیب می نماید. بیشتر بیوسنسورها از مبدل های الکتروشیمیایی ساخته شده اند.
مبدل ها را میتوان به انواع زیر تقسیم بندی نمود:
- مبدل های نوری
2 . مبدل های الکترو شیمیایی )بیشتر بیوسنسورها از این گونه مبدل ها ساخته شده اند.( - مبدل های پیزوالکتریک
- مبدل های گرمایی
کاربردهای مختلف بیوسنسورها
کاربردهای مختلفی برای بیوسنسور ها در پزشکی و بالین وجود دارد که در ذیل اشاره می شود:
- تشخیص ودرمان بیماریها (سرطان، دیابت و…)
- تشخیص بیماریها در سطح ژن (سرطان، دیابت و …)
- تشخیص عوامل بیماریزا
- اندازه گیری داروها و متابولیتهای آنها، کشف داروهای جدید و ارزیابی فعالیت آنها
- ارزیابی و اندازه گیری آنالیتها ی موجود در نمونه بیولوژیک
- تشخیص سریع بیماریها با استفاده از تستهای سریع با استفاده از پوینت او کر، ویژگی این تست ها سریع و ارزان بودن روش آزمایش است.
مبدلهای الكتروشيميايي
مبدلی که که حضور ترکیبات مختلف شیمیایی را به یک سیگنال الکتریکی قابل اندازهگیری تبدیل میکند. بینی یکی از مثالهای مبدلهاي الكتروشيميايي است که به آن اشاره شد. همچنین دستگاه pH متر نیز دارای مبدل الکتروشیمیایی است.
مبدلهاي نوري
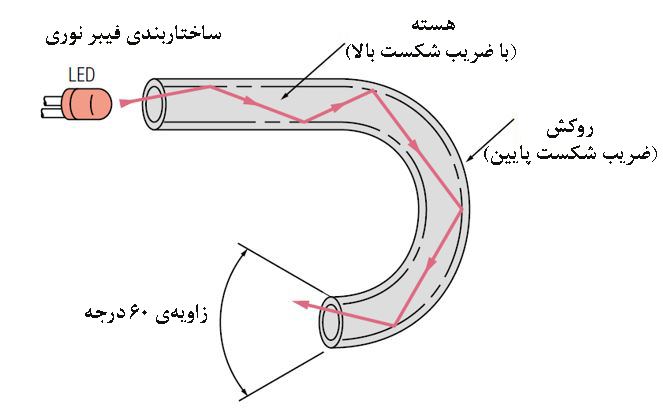
اين نوع از مبدلها، اغلب با استفاده از فيبرهاي نوري ساخته ميشوند. مبدلهای نوری، معمولاً متشكل از دو فيبر نوري، يك منبع نور و يك تشخيصدهنده و يک بستر براي قرارگیری، تثبيت و فعالیت بخش زيستي است. در شکل۲، ساختار یک فیبر نوری، شامل یک هسته و یک پوشش نمایش دادهشده است. پرتو نور بدون اینکه شدت آن کاهش پیدا کند از قسمت مرکزی فیبر با زاویه حدود ۶۰ درجه عبور میکند. هسته مرکزی میتواند ازجنس شیشه یا پلاستیک باشد. هستۀ پلاستیکی انعطافپذیری بیشتری دارد در بیشتر مصارف به کار میرود. درحالی که نوع شیشهای آن، برای شرایط با دمای بالا طراحی شدهاست.
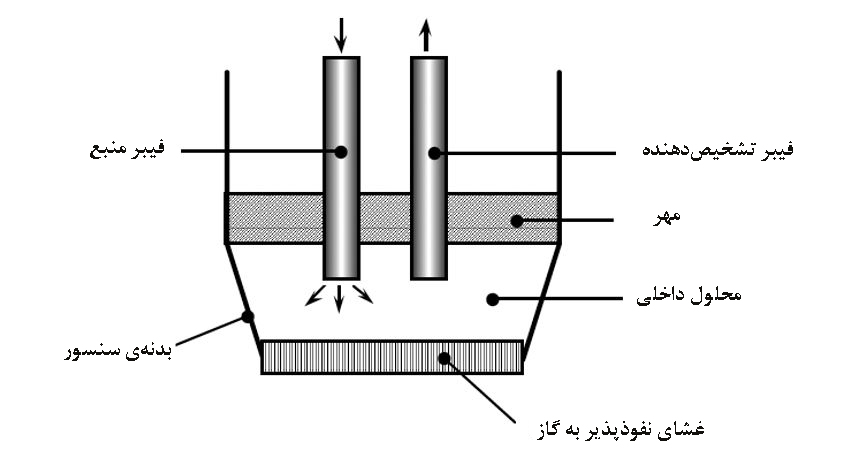
در سنسورهای فیبرنوری، هر دو فيبر نوري، به محفظۀ انجام واكنش منتهي ميشوند. اين محفظه شامل مقداري رنگ يا محلول معرف است كه بوسيلۀ يك غشاي نفوذپذير به گاز، از محلول نمونه جدا ميشود.
مبدلهاي پيزوالكتريك
برخی از کریستالها مثل کوارتز، تورمالین و غیره قابلیت تبدیل تغییرات مکانیکی به اختلاف پتانسیل الکتریکی را دارند و همینطور به شکل معکوس، با اعمال یک اختلاف پتانسیل الکتریکی، به صورت مکانیکی و با فرکانس متناسب با آن شروع به لرزیدن میکنند.کریستالهایی که دارای چنینی ویژگی باشند، پیزوالکتریک نامیده میشوند. با تغيير جرم اين كريستال، فركانس نوسانات آنها نيز تغيير ميكند. دقت نوسانات اين سيستم به حدي بالاست كه از آن ميتوان بهعنوان يك ريزترازوي بسيار حساس(QCM)استفاده كرد. حال اگر سطح این کریستال با يك ماده زيستي (مانند آنتيبادي) پوشانده شود، يك بيوسنسور تمايلي به دست ميآيد که با اتصال آنتیژن هدف و متناسب با غلظت آن، یک پاسخ الکتریکی ایجاد میکند. اين بيوسنسورها ميتوانند تغييرات جرمي درلايۀزيستي يا تغييرات ويسكوزيته محلول را اندازهگيري کنند.
مبدلهاي حرارتي
واكنشهاي زيستي عموماً موجب تغييرات حرارتي ميشوند، اين حرارت به مايع واكنش منتقل شده و يك تغيير دمايي به وجود ميآورد. سنسورهاي حرارتي غالباً از يك جفت ترميستور يا ترانزيستور تشكيل شدهاست. يكي از آنها داراي لايۀزيستي تثبيت شده و ديگري شامل همان لايه اما بصورت غيرفعال است. اختلاف دماي بين آن دو به عنوان تابعي از زمان ثبت ميشود. به دليل اينكه تغيير دمايي براي هر واكنش آنزيمي قابل اندازهگيري است، اين روش به صورت كاملاً عمومي، براي تعداد گستردهاي از آناليتها قابل انجام است. انتخابگري اين سنسورها بسیار بالا و حساسيت آنها پايين و محدود است.
مبدلهاي الكتروكميلومينسانس
اين مبدل براي تمامي آنزيمهايي كه H2O2 توليد ميكنند و يا آنزيمهايي كه وابسته به NADP(H) هستند، به کار میآید. تحت يك پتانسيل اعمالي در حضور يك كمپلكس لومينانس موسوم به روتنيوم ۲- تريس (بيپيريديل)، فوتوني با طولموج ۶۲۰ نانومتر ايجاد ميشود که قابل سنجش میباشد. اين تكنيك براي اندازهگيري گلوكز، اتانل، دي اكسيدكربن، كلسترول و گلوكز ۶ فسفات دهيدروژناز استفاده میشود. در حال حاضر مبدلهای الكتروشيميايي بيشترين توجهات را به خود جلب کردهاند. توسعه سريع ابزارهاي نوري (كاربرد فيبرهاي نوري)، تقاضا براي این نوع از مبدلها را افزایش خواهد داد. همچنین كاربرد مبدلهاي حساس به جرم كه براساس كريستالهاي پيزوالكتريك عمل ميكنند در آيندهاي نزديك افزايش خواهند يافت.
همانگونه که در این بخش توضیح داده شد، مبدلها یکی از اجزای کلیدی در حسگرها محسوب میشوند که وظیفه آنها تبدیل پاسخ بخش تشخیصدهنده به یک سیگنال قابل تشخیص و تکرارپذیر است. نانومواد به علت داشتن نسبت بالای سطح به حجم، میتوانند موجب افزایش کارآیی در حسگرها شوند. استفاده از نانومواد و یا نانوساختارها در ساختمان بیوسنسورها، دستۀدیگری از حسگرها تحت عنوان نانوبیوسنسورها را به وجود میآورد.
تثبیت بخش زیستی بر روی سنسورها
همانطور که قبلا اشاره شده در ساختمان زیستحسگرها، یک بخش فعال زیستی به عنوان شناساگر مورد استفاده قرار میگیرد. فرآیند قرارگیری بخش زیستی بر روی یک بستر یا بخشی از کل حسگر را تثبیت میگویند. بيشتر آنزيمهاي محلول بسيار ناپايدار هستند و در طول مدت زمان کوتاهی غیرفعال میشوند. تثبيت يك آنزيم (يا هر بخش زيستي ديگر) در شرايطي نزديك به محيط طبيعي آن، باعث ايجاد آنزيمهايي كارآمد و پايدار ميشود. همچنين با انجام فرآیند تثبيت، اجزای بخش زيستي به صورت فشرده در يك محل جمع ميشوند و کارآیی بيوسنسور به حداکثر ميرسد. در نهايت، با تثبيت آنزيم، امکان استفادۀ مجدد از بیوسنسور در دفعات فراهم میشود. روشهاي تثبيت به دو گروه فيزيكي و شيميايي تقسيم ميشوند، که درادامه به معرفی آنها میپردازیم.
تثبيت فيزيكي
تثبيت فيزيكي از طريق ميانكنشهاي توپولوژيك، آبگریزی و يا الكترواستاتيك انجام ميگيرد و آنزيم از نظر شيميايي در این برهمکنشهای فیزیکی، دست نخورده ميماند. نقطه ضعف آن، اتصال ضعيف جزء زيستي به بستر است كه باعث جدايي لايه زيستي ميشود. روشهای مختلفی جهت تثبیت فیزیکی بخش زیستی بر روی بیوسنسورها مورد استفاده قرار میگیرد که به دو مورد از آنها اشاره میشود.
جذب فيزيكي به سطح الكترود
جذب يك آنزيم روي يك بستر نامحلول (يا الكترود) با ميانكنشهاي يوني، قطبي، پيوند هيدروژني، القاي آب گریزی صورت میگیرد. الكترود براي مدت زماني مشخص داخل محلولي از آنزيم غوطهور ميشود و يا اينكه، قطرهاي از محلول آنزيمي روي سطح الكترود گذاشته و خشک میشود. اين روش ساده است اما نقطه ضعف جدی آن این است که آنزيم متصل شده به آساني با تغيير در دما، بستر، حلال، pH و يا اثر همرفت جدا میشود.
خمير كربن
اولين گزارش تثبيت آنزيم در الكترودهاي خمير كربن (CPE) در سال ۱۹۸۵ بيان شد که در آن، آنزيم گلوكزاكسيداز با خميري متشكل از پودر گرافيت و روغن سيليكون مخلوط شد. در حال حاضر آنزيمهاي ديگر به ويژه اكسيدوردوكتازها داخل CPE تثبيت شدهاند. در این روش بخش زیستی با جذب سطحی در قسمتهای متخلخل خمیرکربن به دام میافتد. تثبيت آنزيم با استفاده از الكترودهاي خمير كربن به دليل سادگي بيش از حد آن بسيار جذاب است. ساخت خمير با مخلوط كردن تركيبات مختلف به وسيلۀ كاردك به راحتي قابل انجام است. از مزایای ديگر الكترود خمير كربن نسبت به ديگر الكترودهاي جامد، قابليت تجديدپذیری آن است. بعد از چند آزمايش، سطح الكترود به آساني و با جابجا كردن لايه استفاده شده و فرسوده تجديد ميشود چراكه خمير ميتواند به عنوان يك مخزن آنزيم عمل كند.
تثبيت شيميايي
اين نوع تثبيت، از واكنشهاي شيميايي استفاده ميكند كه گروههاي عامل موجود در پوستۀ پروتئين را درگير ميكند. از جملۀ اين گروهها ميتوان گروههاي آمينوي α، حلقه فنلي تيروزين، گروههاي كربوكسيل β و γ، گروه سولفيدريل سيستئين و گروه ايميدازول هيستيدين را نام برد. درواقع در روش تثبیت شیمیایی بخش زیستی به صورت کووالان به گروههای عامل ایجاد شده در سطح الکترود متصل میشوند که به دو نمونه از این روشها اشاره خواهیم کرد.
اتصال متقاطع
پوسته پروتئيني آنزيم شامل گروههاي آميني آزاد است كه ممكن است با يك تركيب دو عاملي واكنش دهد. پرکاربردترین عامل اتصال متقاطع، گلوتارآلدهيد است كه معمولاً به همراه آلبومين سرم گاوي (BSA)، به كار ميرود و اين روش روي هر سطحي قابل انجام است (مثل الكترودهاي چاپ اسكرين). مشكل اصلي آن است كه بسياري از آنزيمها به عامل اتصال متقاطع حساس هستند، بنابراين ممكن است فعاليتشان را از دست بدهند.
اتصال شیمیایی به سطح الكترود
اتصال شيميايي تركيب زيستي به سطح بستر با استفاده از يك مولكول فاصله دهنده انجام ميشود تا از تخريب پروتئين جلوگیری شود. با اكسايش شيميايي يا با تيمار حرارتي گرافيت در حضور O2، گروههاي عاملي سطحی تشکیل ميشود. با اصلاح شيميايي سطح، گروههاي عاملي متنوعي از قبيل: هيدروكسي، اكسو، انيدرو و كربوكسي و كينوني به وجود میآید كه ميتواند عامل اتصال به آنزيم باشند. پلاتين بايد قبل از سيلاندار كردن اكسيد شو. عنصر طلا به طور قوی به مشتقات تيول متصل ميشود بنابراین براي تثبيت بسیار مناسب است.
معيارهاي سنجش عملكرد سنسورها
برای ارزیابی و ستجش عملکرد حسگرهای زیستی لازم معیارهای زیر در نظر گرفته شود:
۱. قابليت انتخابگري: يعني توانايي برقراري تمايز بين مواد مختلف. قابليت انتخابگري مربوط به ويژگي عمل و کارکرد بخش انتخابگر است، هرچند گاهي خود مبدل نيز موجب بروز قابليت انتخابگري ميشود.
۲. حد تشخيص: معمولاً بايد زير حد ميليمولار باشد اما در موارد خاص تا حد فمتومولار هم پايين ميآيد.
۳. دقت: بايد بهتر از ٪۵± باشد.
۴. شرايط محلول: شرايطي مثل pH، درجه حرارت و قدرت يوني بايد ملاحظه شود.
۵. زمان پاسخ: مدت زمان رسیدن سیگنال سنسور به ۹۹/۳% تغییرات صورت گرفته در محیط میباشد و هر چه این زمان کوتاهتر باشد، نشان از کارآیی بیشتر سنسور دارد. به عنوان مثال برای یک سنسور دمایی که از یک ظرف یخ (صفر درجه سانتیگراد) به یک اتاق با دمای ۱۰ درجه سانتیگراد منتقل شود، مدت زمان لازم برای رسیدن به دمای ۹/۹۳ درجه سانتیگراد را زمان پاسخ سنسور میباشد.
۶. زمان بازيابي: مدت زمان طي شده قبل از آمادگي حسگر براي سنجش نمونهي بعدي است كه نبايد بيشتر از چند دقيقه طول بكشد.
۷. طول عمر: مدت زمانی که سنسور میتواند پاسخ دقیق و صحیح به تغییرات محیطی داشته باشد و معمولاً با پايداري بخش تشخيصدهنده مرتبط است.
حوزههاي كاربرد سنسورها
- سلامت
حفظ سلامتي حوزۀ اصلي كاربرد بيوسنسورها و حسگرهای شيميايي است. براي نشان دادن وضعيت متابوليك بيمار، اندازهگيري منظم خون، گازها، يونها و متابوليتها لازم است. جدول زیر فهرستي از آزمايشات رايج را نشان ميدهد كه براي كار با بيماران و تشخيص بيماري به طور رايج موردنياز است.
جدول۱- آزمايشات رايج در پزشكي تشخيصي
روش سنجش | آناليت |
بيوسنسور آمپرومتري (الکتروشیمیایی) | گلوكز |
بيوسنسور پتانسيومتري (الکتروشیمیایی) | اوره |
بيوسنسور آمپرومتري (الکتروشیمیایی) | لاكتات |
ايمنيسنجي لومينسانس شيميايي | هپاتيت B |
ايمنيسنجي مبتني بر پيزوالكتريك | كانديد البيكنس |
بيوسنسور آمپرومتري (الکتروشیمیایی) | كلسترول |
بيوسنسور پتانسيومتري (الکتروشیمیایی) | پني سيلينها |
الكترود يون گزين شيشهاي | سديم |
الكترود تبادل يون انتخابي | پتاسيم |
سنسور فلورسانت | اكسيژن |
الكترود يون گزين شيشهاي | pH |
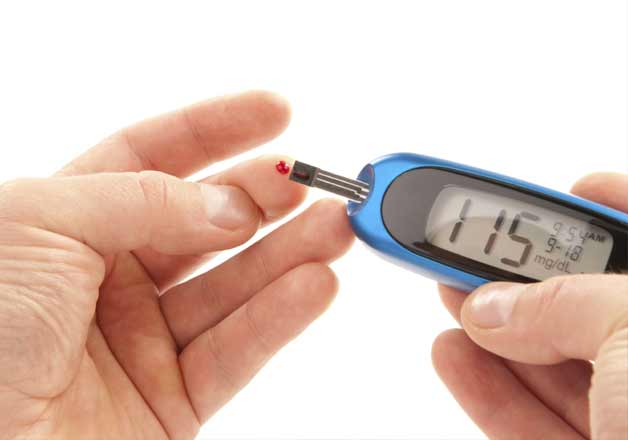
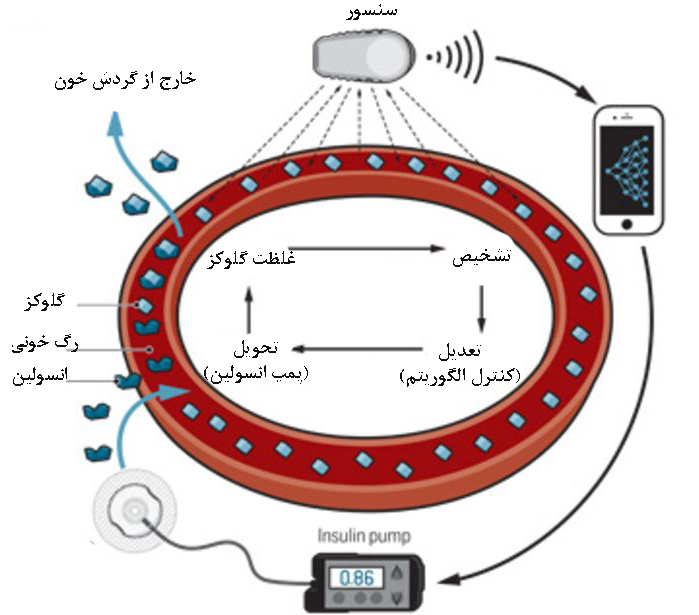
يكی از كاربردهای بالقوه، ساخت يك حسگر كاشته شده براي سنجش مداوم يك متابوليت است كه ميتواند از طريق يك ريزپردازنده، به يك سيستم تحويل دارو متصل شود. اين وسيله در بيماريهاي مزمن(مثل ديابت) بسيار مفيد است. چنين سنسوري، با سنجش مداوم گلوكز خون، مقدار مشخصي از انسولين به طور خودكار به جريان خون بيمار ترشح میکند. این سيستم با عنوان «لوزالمعده مصنوعي»، نسبت به ابزارهاي رايج آناليز قند خون كه به صورت ناپيوسته عمل ميكنند مفيدتر است، چرا كه در بيوسنسورهاي معمولي، انگشت شست با سوزن خراش داده ميشود و سپس در فواصل زمانی مشخص، دوز زيادي از انسولين را وارد بدن میکند ولی دراین روش، رهایش انسولین در داخل بدن به صورت خودکار توسط سنسور پس از اندازهگیری میزان قند خون صورت میپذیرد و از مشکلات پایش دائمی سطح قند خون بیماران دیابتی میکاهد.
كنترل فرايندهاي صنعتي
حسگرها در جنبههاي مختلف فرايندهاي تخمير مانند اندازهگيري عوامل مختلفی مثل pH، دما و مقادیر CO2 و O2 به كار ميروند. البته بيوسنسورهايي كه تمام يا تعدادي از واكنشدهندهها و محصولات را سنجش ميكنند نيز در دسترس هستند(مثل مواردي كه براي قندها، مخمرها، مالتها، الكلها، تركيبات فنولي و بعضي از محصولات جانبي وجود دارند). سنجش مداوم مواد درگير در يك فرايند صنعتي، باعث بهتر شدن كيفيت محصول و افزايش بازدهي شده، و نيز قابليت ايجاد تغيير دركيفيت مواد خام را امکانپذیر میکند. همچنين با بهبود اتوماسيون كارخانهاي، موجب بهينهسازي مصرف انرژي ميشود.
اندازهگيريهاي محيطي
ترکیب مواد مختلفي در هوا، آب، خاك و ديگر محيطها وجود دارندکه با روشهای اندازهگیری محیطی سنجیده میشوند. بعضي از موادي كه در آب نياز به اندازهگيري دارند عبارتند از: اكسيژن، pH، نمك، نيترات، فسفات، كلسيم و فلورايد. اندازهگيري مواد خطرناک و سمی مثل حشرهكشها، كودهاي شيميايي و نيز فاضلابهاي خانگي و صنعتي، نياز به تحليلهاي گستردهتري از نظر آلودگيهاي محيطي دارند. نگرانيهايي درمورد برهمزنندههاي تعادل محيط زيست وجود دارد كه در غلظتهاي بسيار پايين (ng l-1) عمل ميكنند. اين مواد شامل گسترۀ وسيعي از استروژنها و تركيبات مشابه هستند. در مورد چنين موادي اندازهگيري پيوستۀ آنها و در مورد ديگر مواد، سنجش تصادفي و گاه به گاه لازم است. به علاوه آلودگيهاي، كشاورزي، باغباني، دامپزشكي و معدنداري از سایر حوزههايي هستند كه براي سنجشهاي محيطي از سنسورها استفاده ميكنند.
جمعبندی و نتیجهگیری
روشهای آزمایشگاهی شناسایی و تشخیص نیازمند تجهیزات گرانقیمت، کارشناسان متخصص و آموزشدیده و زمانبر است. استفاده از حسگرها روشی برای شناسایی و تشخیص سریع و کمهزینه است که از آنها حتی در محلی خارج از آزمایشگاه نیز میتوان بهره برد. به همین دلیل فناوری حسگرها در طی دهههای گذشته توسعه زیادی پیدا کردهاست و تبدیل به یک زمینه تحقیقاتی و صنعتی بین رشتهای شده است. حسگرها از سه بخش اصلی تشکیل شدهاند: ۱- بخش تشخیصدهنده: این بخش باید بتواند به طور انتخابی یک ماده خاص و یا یک نوع خاصی از مواد را شناسایی کند. این بخش محلی است که برهمکنش بین تشخیصدهنده و آنالیت هدف در آن اتفاق میافتد. ۲- مبدل: این بخش برهمکنش بخش تشخیص دهنده و آنالیت هدف را به یک سیگنال قابل مشاهده تبدیل میکند. مبدلها انواع مختلفی دارند. ۳- بخش سوم، سیگنالهای تولید شده در مبدل را به اطلاعات قابل استفاده تفسیر میکند.حسگرها کاربردهای فراوانی در حوزه سلامت مانند تشخیص بیماریهای مختلف، حوزه صنعت و حوزه محیط زیست دارند.

