
فتوکاتالیزورها
فتوکاتالیزورها
- مقدمه
نیاز ضروری به کاهش آلودگی های زیست محیطی مربوط به سوخت های فسیلی و جایگزینی وجود دارد. این سوخت ها با منابع انرژی پاک و تجدید پذیر است. انرژی های تجدیدپذیر مختلفی وجود دارند. منابعی مانند نور خورشید، باد، آب و زیست توده. در این میان انرژی خورشیدی به وفور، بدون هزینه و در دسترس است و میتواند برای برنامه های مختلف تنظیم شود. نور خورشید در فرآیندهای فوتوکاتالیزگری استفاده میشود[1]. با توجه به عمر طوالنی پیش بینی شده خورشید، انرژی خورشیدی به عنوان یک منبع پایدار قطعی در نظر گرفته میشود و می توان از نور خورشیدی برای تامین نیاز انرژی استفاده کرد، اما ذخیره سازی آن دشوار است. انرژی خورشیدی را می توان به طور مستقیم جمع آوری کرده و به گرما، برق و بسیاری از اشکال انرژی دیگر تبدیل کرد(2-5) پیشرفت در زمینه نیم رساناها باعث نوآوری هایی شده که امکان تولید در مقیاس بزرگ پنل های خورشیدی را فراهم میکند. با این حال، چگونگی ذخیره سازی برق مقرون به صرفه همچنان یک چالش بزرگ است. یکی دیگر از پارامترهای مهم برای برداشت انرژی خورشیدی و ظرفیت ذخیره انرژی خورشیدی واکنش های فتوشیمیایی است زیرا پیوندهای شیمیایی محیط مفیدی برای ذخیره انرژی هستند. در طول میلیاردها سال مقیاس انرژی ذخیره شده توسط واکنش های شیمیایی به شدت افزایش یافته است و مقدار زیادی انرژی از ذخایر سوخت فسیلی به دست می آید. استفاده از سوخت های فسیلی برای تولید انرژی بسیار پرهزینه است و آلاینده ها را وارد محیط میکند.به منظور کاهش هزینه وآلودگی، محققان استفاده از فتوکاتالیز را پیشنهاد کرده اند[9-6]. شناخت این فرآیند، دانشمندان را ترغیب کرد تا فناوری های کارآمدتر و کم هزینه تر را توسعه دهند و نیازهای روزافزون انرژی جهان را برآورده کند. این مقاله یک نمای کلی از فوتوکاتالیز و اصول اساسی، مکانیسم ها، برنامه ها و چالش ها را ارائه میدهد.
- مکانیسم فتوکاتالیز
یک واکنش فوتوکاتالیزوری به انرژی نور (فوتون) یا طول موج بستگی دارد و معمولا از مواد نیم رسانا به عنوان کاتالیزور استفاده میشود. وقتی نور بر روی فوتوکاتالیزورها میتابد، به دلیل ساختار الکترونیکی آنها فرآیند اکسایش و کاهش انجام میشود که با یک باند ظرفیت پر و یک نوار هدایت خالی ایجاد میشود(10-11). مراحل اساسی در فرآیند فتوکاتالیز نیم رسانا به شرح زیر است:
- وقتی فوتون ها با انرژی خاص روی سطح یک نیمه هادی می تابند، اگر انرژی پرتوهای فرودی متناسب یا بیشتر از انرژی فاصله دو نوار باشد، الکترون های نوار والانس تحریک میشوند و به سمت نوار هدایت حرکت میکنند.
- از آنجا که الکترون ها جابجا شده اند، حفره هایی در نوار والانس نیمه هادی باقی می ماند که این حفره ها با اتم های آب واکنش داده و رادیکال های هیدروکسیل تولید میکنند که دارای قدرت اکسید کنندگی بوده و مسئول تخریب آلایند ها هستند؛ این فرآیند اکسایش نامیده میشود.
- الکترون های نوار هدایت با احیا گونه های اکسیژن ، سوپراکسید تشکیل می دهند و تخریب با این گونه ها نیز ادامه می یابد. رادیکال های اکسید کننده هیدروکسیل و سوپراکسید تولید شده، با آلاینده ها واکنش داده و تجزیه میشوند؛ فرآیند اولیه فتوکاتالیز در شکل 1 نشان داده شده است.
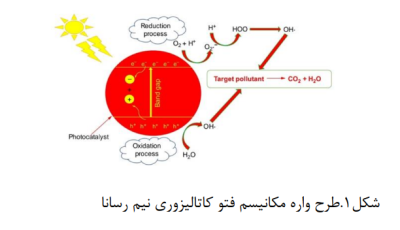
- تاثیر پارامترهای فیزیکی بر فعالیت فتوکاتالیزوری
پارامترهای مختلفی روی کارایی کاتالیزورها اثرگذار است.(12-17). دراین بخش تاثیر عوامل مختلف بر فعالیت فوتوکاتالیزوری را مورد بررسی قرار می دهیم.
- pH
در فرآیند فتوکاتالیزوری، pH محلول فاکتور مهمی میباشد، زیرا فرآیند تخریب فتوکاتالیزوری را بسیار تحت تاثیر قرار میدهد. بعنوان مثال تخریب فتوکاتالیزوری یک رنگ سمی و تیتانیوم اکسید در شرایط مختلف pH نشان می دهد تخریب در محیط های اسیدی( pH کمتر از 5)کمتر است. در محیط های قلیایی( pH بالاتر از 10)، وجود ذرات هیدروکسیل راندمان تخریب را افزایش میدهد. با این حال، یک کاهش غیر منتظره در تخریب در محدوده pH -1113 مشخص شد که در آن رادیکالهای هیدروکسیل به سرعت جستجو میشوند و با رنگ ها پاسخ نمیدهند. اثر pH روی سرعت واکنش را میتوان برحسب برهمکنش های الکتروستاتیکی بین ذرات باردار و آلاینده ها تفسیر کرد که اینها متعاقبا بر جذب و خواص سطح تاثیر میگذارند(18).
- شدت نور
میزان تخریب فتوکاتالیستی در اکثر موارد به شدت نور بستگی دارد. واکنش های فتوکاتالیزوری تحت طول موج های مختلف از منابع نوری انجام می شوند. کاتالیزگر تیتانیوم دی اکسید دارای شکاف باند بزرگ ( 3,2الکترون ولت) است که بیشتر در منطقه یو وی قرار می گیرد. سرعت واکنش تخریب تیتانیوم دی اکسید برای شدت های مختلف نور متفاوت است. سرعت واکنش با افزایش شدت نور افزایش مییابد. در محدوده 0 تا 20 سرعت واکنش به ریشه دوم شدت نور بستگی دارد. البته سرعت واکنش در تابش نور با قدرت خیلی بالا به دلیل تمایل زیاد به نوترکیبی کاهش مییابد(19).
- غلظت اولیه آلاینده ها
یکی دیگر از عوامل اساسی در میزان تخریب، نوع آلاینده و غلظت آن است. بسیاری از محققان فعالیت فوتوکاتالیزوری را به صورت مقایسه ای نشان داده اند. شرایط کاری با استفاده از کاتالیزگرهای مشابه ولی تغییر غلظت آلاینده ها تا حد زیادی بر زمان تخریب آنها تاثیر می گذارد. یک پژوهش نشان داد راندمان متفاوتی را در شرایط عملیاتی مشابه ولی غلظت رنگ اسید نارنجی 7 (600-25 میلی گرم در لیتر) نشان میدهد. نتایج بدست آمده نشان می دهد که تخریب کامل با غلظت رنگ 25-100 میلی گرم در لیتر به دست میآید. در غلظت رنگ بالاتر( 200-600 mg/L) سرعت تخریب کاهش مییابد(20-21 ).
- دمای واکنش
محققان تأثیر دمای واکنش را بر بازده فوتوکاتالیستی مطالعه کرده اند؛ آنها مشاهده کردند که افزایش دمای بالای 80 درجه سانتیگراد باعث افزایش نوترکیبی میشود. جفت الکترون- حفره همراه با دفع گونه های واکنش دهنده جذب شده که در نهایت منجر به عملکرد فوتوکاتالیزوری کمتر خواهد شد. لذا گرما برای یک سیستم فوتوکاتالیزوری مورد نیاز نیست؛ این سیستم ها می توانند در دمای اتاق کار کنند ، دمای واکنش ایده آل برای عمل فوتوکاتالیزوری 2TiO در محدوده 20 تا 80 درجه سانتیگراد است. این محدوده دمای ایده آل به انرژی فعال سازی مواد در طول فوتوکاتالیز متکی است(19).
- جرم کاتالیزگر
مقدار کاتالیزگر نیز بر کارایی فعالیت فوتوکاتالیستی تأثیر می گذارد. با افزایش مقدار کاتالیزگر، تعداد جایگاه های فعال موجود در سطح نیمه هادی افزایش یابد، که به نوبه خود تعداد رادیکال های تولید شدهOH •و • افزایش می یابد که در نتیجه، میزان تخریب فوتوکاتالیستی افزایش می یابد. کنستانتینو و همکارانش گزارش کردند که میزان تخریب مستقیماً با غلظت کاتالیست در هر سیستم راکتوری متناسب است. با این حال، با افزایش بار کاتالیست بیشتر از مقدار بهینه، به دلیل کاهش عمق نفوذ نور به داخل محلول ، سرعت تخریب مطلوب نخواهد بود و به دلیل پراکندگی نور کاهش می یابد(22-23).
- محدودیت های فتوکاتالیز
فوتوکاتالیز دارای محدودیت های زیر است:
- پتانسیل باند نامناسب مواد نیمه هادی
- مقدار کم انتقال بارها
- نوترکیبی زیاد حامل های بار
این مشکلات باید به درستی حل شوند تا به طور کلی بازده فوتوکاتالیزوری مواد افزایش یابد.
- کاربردهای فتوکاتالیزور
- شکافت آب فوتوکاتالیزوری
نور خورشید و آب فراوان ترین، پاک ترین، تجدیدپذیرترین و طبیعی ترین منابع انرژی روی زمین هستند. تبدیل آب به هیدروژن به عنوان یک راه حل ایده آل برای غلبه بر کاهش انرژی و مسائل مربوط به محیط زیست و سوخت های فسیلی تعریف شده است. تولید هیدروژن از طریق شکافت آب با فتوکاتالیزگر 2TiO برای اولین بار در سال 1972 گزارش شد. تقسیم آب فوتوکاتالیزوری به هیدروژن و اکسیژن با استفاده از کاتالیزگرهای نیمه هادی یک روش تجدید پذیر برای تولید هیدروژن است. در این شکافت، واکنش های اکسیداسیون و احیا به طور همزمان هنگام تابش نور خورشیدی انجام میشوند. فرآیند اصلی تقسیم آب فوتوکاتالیستی در شکل 2 نشان داده شده است(24-26).
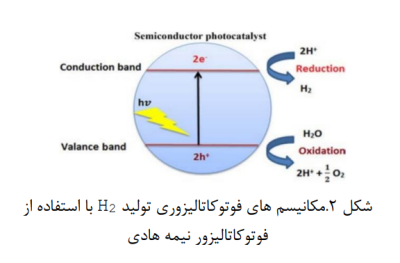
- تخریب فتوکاتالیزوری
توسعه فوتوکاتالیزگر های نیم رسانا مبتنی بر انرژی خورشیدی در زمینه های اصالح محیط زیست و ذخیره انرژی توجه زیادی را به خود جلب کرده است. آلاینده های آلی مختلف توسط بخش های صنعتی و کشاورزی وارد محیط زیست می شوند.وجود آلاینده های آلی در فاضالب می تواند سطح اکسیژن را تغییر دهد که می تواند منجر به مشکلات شدید در اکوسیستم شود. تخریب فوتوکاتالیزوری به عنوان یکی از راه های موثر حذف آلاینده های آلی از فاضلاب درنظر گرفته می شود. بنابراین توسعه مواد کاتالیزوری که در نور مرئی فعال و موثر هستند برای حل مشکالت حیاتی مرتبط با انرژی و محیط زیست، ضروری است. در طول چند دهه گذشته،مواد نیم رسانای مختلفی مانند اکسیدهای فلزی، سولفیدها و اکسی نیتریدها به عنوان فوتوکاتالیزگر کارآمد برای تخریب آلاینده های سمی در آب شناخته شده اند. بین مواد نیمه هادی، 2TiO یکی از گسترده ترین مواد مورد مطالعه برای تخریب آلاینده های آلی موجود در آب به دلیل پایداری نوری، نامحلول بودن و غیر سمی بودن آن میباشد. با این حال، 2TiO تنها تحت نور UV موثرتر است، که کاربردهای عملی آن را محدود می کند(27).
- آلودگی آب
آلودگی آب مشکلی عمده در سرتاسر جهان است .در صورت وجود آلاینده ها در غلظت های بالا، آب آلوده نمی تواند زندگانی را تثبیت کند و به همین دلیل به آب مرده معروف است و در نتیجه منجر به مرگ انسان ها، حیوانات، گیاهان، پوشش های گیاهی و جانوری، و غیره میگردد. در قرن بیست و یکم، آلودگی آب تاثیرات زیادی روی انسان و شیوع انواع بیماری ها از جمله اسهال خونی، سالمونال، کریپتوسپوریدیوم ،هپاتیت، سرطان، وبا، جوش های پوستی، عوارض معده، مشکلات تنفسی، بیماری های کبدی، مشکالت عصبی، اختلالات تولید مثلی، و... دارد. پیشرفت و تکامل بشر تمامی آب های زمین را آلوده میکند. امروزه، دریاها، دریاچه ها، آب های زیرزمینی و سایر موارد به طور مداوم توسط ترکیبات مصنوعی و مواد نا ایمن دست ساخته از بین می روند. انواع مختلفی از آلودگی آب شناخته شده است که خطرناک ترین آنها شامل آلودگی مواد غذایی، آب های سطحی، فاضلاب ها، آب های زیرزمینی، آلودگی میکروبیولوژی و شیمیایی آب و آلودگی مواد معلق میشود. به خوبی مشخص است که عامل اصلی آلودگی آب، نتایجی از اعمال انسان است. به علاوه، این نوع آبها برای نوشیدن و حتی برای شنا بسیار ناامن هستند. یکی از این موارد آلاینده های رنگی هستند.تا کنون حدود 100000 رنگ مصنوعی صنعتی به عنوان مهمترین رنگ های استفاده شده در صنایعی مانند صنایع نساجی، دباغی، کاغذ، غذایی، رنگ مو، سلول های الکتروشیمیایی، عکس، و غیره مورد استفاده قرار گرفته اند. رنگ ها غالبا آلاینده های اصلی هستند که حتی در غلظت های بسیار کم در پساب های صنعتی قابل رویت هستند. تصویر و ساختار انواع مختلف رنگ های مصنوعی در شکل ۳ نمایش داده شده است. به دلیل خاصیت رنگ دهی رنگها، این موضوع یک مسئله جدی برای تمامی آب های زمین است .در حضور آلاینده های رنگی، نور خورشید نمی تواند به طور کامل به داخل آب نفوذ کند و این امر فرآیند طبیعی فتوسنتز در داخل دریا، رودخانه ها، برکه ها، و... را مختل می کند و منجر به کاهش اکسیژن میشود. این امر برای تجزیه بیولوژیکی عامل آلودگی در داخل آب مورد نیاز است. اگر به تفصیل به طبقه بندی رنگ ها بپردازیم، به راحتی میتوانیم دریابیم که آزورنگ ها (رنگهای دارای بنیان دوظرفیتی نیتروژن) مهمترین گروه رنگ ها را به خود اختصاص داده اند، و عمدتا حدود 50 درصد از کل رنگ های مورد استفاده در صنایع، رنگ های آزوئیک هستند. آزورنگها از پیوند دوگانه نیتروژن ساخته میشوند و اتم نیتروژن به ترکیبات حلقوی (حلقه های نفتالن یا بنزن) متصل است. علاوه بر این، به دلیل وجود گروه های عاملی کربوکسیل، هیدروکسیل، آمین یا سولفوکسیل، ویژگی های آمفوتری (خاصیت اسیدی-بازی) دارند. گفته میشود آزورنگ ها بسته به PH محیط میتوانند به صورت آنیونی (بدون پروتون در گروه اسیدی)، کاتیونی (پروتون دارشده در گروه آمینی) یا غیریونی عمل کنند.
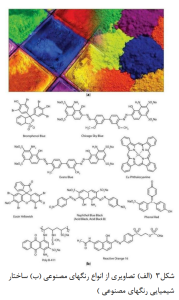
- فناوری هایی برای حذف رنگ از آب آلوده
روش های گوناگونی برای حذف آلودگی از فاضلاب ها به کار گرفته می شود.
- فرایندهای تصفیه متعارف: فرایندهای تصفیه متعارف شامل انعقاد، لخته سازی، و... میشود. اما این فرایندها آهسته هستند و مقدار زیادی لجن تولید می کنند که جابجایی و دفع نیز یکی از مشکلات عمده این فرایندها است. فرایندهای دیگر شامل کربن های فعال است که در مقابل رنگ های پراکنده و ثابت چندان موثر نیستند. در این مورد، بازیافت یکی از بزرگترین مسائلی است که برای حفظ پایداری کلی جاذب ها نیاز هست و نیاز به هزینه بالایی دارد.
- فرایندهای بازیافت ثابت: جداسازی با غشاء، تبادل یون، اکسیداسیون. معایب آن شامل فشار بالا، مصرف بالای انرژی، و مواد شیمیایی مورد نیاز است .
- فرایندهای حذف مدرن: این فرایندها اساسا شامل فرایند اکسیداسیون پیشرفته میشود. فرایند اکسیداسیون پیشرفته لجن تولید نمیکند، و کم مصرف یا بدون مصرف مواد شیمیایی است. همچنین، کارایی بالایی برای رنگ های مقاوم دارد. فرایند اکسیداسیون پیشرفته به عنوان فناوری جذاب شناخته میشود که دارای قدرت اکسیداسیون سریع آلاینده هاست و غیرانتخابی است. فرایند اکسیداسیون پیشرفته منجر به تولید رادیکالهای هیدروکسل بسیار واکنش پذیر می شود که میتوانند تقریبا هر ترکیب شیمیایی موجود در آب را که اغلب با سرعت کنترل شده پخش میشوند را اکسید کند. رادیکال های ذکرشده با کمک تعدادی از اکسیدانهای اولیه به عنوان مثال، اوزون، پراکسید هیدروژن، اکسیژن و همچنین/یا منابع انرژی مانند نور UV یا کاتالیزورها ساخته میشوند.
تصفیه آب فوتوکاتالیزوری با استفاده از فوتوکاتالیزگرهای مبتنی بر 2TiO، در واقع شناخته شده ترین فرایند اکسیداسیون پیشرفته برای پاکسازی محیط است. فتوکاتالیزورهای مبتنی بر دی اکسید تیتانیوم 2TiO با استفاده از تولیدات حفره ها و الکترون ها، و اثر تابش نور می توانند طیف وسیعی از آلاینده ها را برا تشکیل یون های غیرآلی O2H، و 2CO معدنی کنند(18).
- فتوکاتالیز در تصفیه آب
امروزه، دو حوزه مهم شامل تولید باصرفه اقتصادی و تخریب آلاینده ها به عنوان پیشروترین تحقیقات علمی موفق به شمار می روند. مشاهده میشود که فوتوکاتالیز برای تصفیه آب با استفاده از نور خورشید به عنوان منبع انرژی پایدار و پایان ناپذیر به عنوان روشی فوق العاده است. فوتوکاتالیز در واقع روشی عالی برای تخریب آلاینده ها و تولید 2H با شکافت آب است. فوتوکاتالیز را میتوان به عنوان واکنش کاتالیزوری شامل تولید یک کاتالیزگر با جذب نور تعریف کرد. موقعیت مناسب نوارهای ظرفیت(VB) و نوارهای هدایت(CB) در نیمه رساناها (شکل 4) شرایط مناسب را برای جذب نور و عمل فوتوکاتالیزوری فراهم میسازد. فوتوکاتالیزورهای نیمه هادی در شکافت آب برای تامین سوخت هیدروژن در آب و همچنین تصفیه هوا استفاده می شوند. در مقایسه با فوتوکاتالیزگرهای نیمه رسانا قابل دسترس، فوتوکاتالیزگرهای مبتنی بر 2 TiO به دلیل بی اثری بیولوژیکی، پایداری در برابر نور، یعنی آسیب پذیر نبودن در برابر خوردگی نوری آند، و هزینه پایین تولید، منحصر به فرد هستند. تصفیه آب و هوای فوتوکاتالیزوری با استفاده از فوتوکاتالیزورهای مبتنی بر 2TiO به دلیل کارایی و سازگاری با محیط زیست یک فرایند اکسیداسیون پیشرفته بسیار مهم است(18).
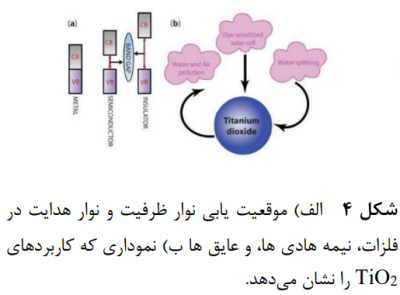
- سازوکار عمومی فوتوکاتالیز
در فرایند فوتوکاتالیز افزایش سرعت یک واکنش شیمیایی توسط نور صورت می گیرد .این امر در نتیجه تسریع یک واکنش نوری در حضور کاتالیزگر است .این نوع واکنش ها با جذب فوتونی با انرژی کافی (برابر یا بالاتر از انرژی شکاف نواری کاتالیزگر) ایجاد میشوند. جذب منجر به انتقال یک الکترون از نوار ظرفیت کاتالیزگر نیم رسانا به نوار رسانا شده و باعث جدایی بار می شود. بنابراین، حفره در نوار ظرفیت ایجاد می کند. فرایند در شکل 5 نشان داده شده است.
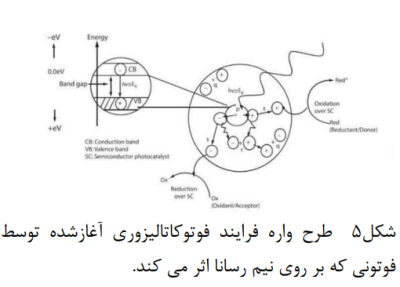
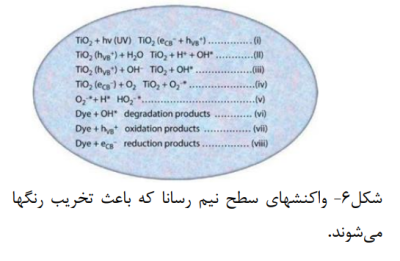
در صورتی که واکنش فوتوکاتالیز شده مطلوب باشد، باید تا آنجا که امکانپذیر است، از ترکیب مجدد الکترون و حفره جلوگیری شود. هدف نهایی این فرایند، واکنش بین الکترون های فعال شده با اکسنده ها برای تولید محصولی احیاشده و واکنش بین حفره های تولیدشده با عامل احیاکننده برای تولید محصول اکسیدشده است. الکترون های فوتو تولید شده می توانند رنگ را کاهش دهند یا با گیرنده های الکترون مانند اکسیژن محلول در آب ، واکنش دهد و آن را به آنیون رادیکال سوپراکسید کاهش دهند. حفره های تولیدشده نوری می توانند مولکول آلی را اکسید کنند تا به شکل درآیند، یا با و یا واکنش دهند و آنها را به رادیکال های OH تبدیل کنند. حفره ها همراه با سایر اکسنده ها (مانند رادیکال های پراکسید)، مسئول تجزیه ی ناهمگن نوری 2TiO در تخریب رنگها هستند. رادیکالهای OH حاصل شده که عامل اکسیدکننده ی بسیار قوی هستند، (پتانسیل احیا استاندارد 2/8 ولت) می توانند اکثر آزو رنگ ها را به محصولات معدنی اکسید کنند.(18و15-12) واکنش های مربوطه در سطح نیم رسانا که باعث تخریب رنگها میشود در شکل 6 نشان داده شده است.
- کاربرد نانومواد برای فرآیند تخریب رنگ
کاتالیزگرها قلب فرآیند تخریب رنگ فوتوکاتالیزوری هستند. برای حذف موثر رنگ ها، یک کاتالیزگر باید دارای خواصی مانند تحرک الکترون، انرژی باند، شفافیت، بی اثری شیمیایی و بیولوژیکی، پایداری نور، عدم سمیت، سازگاری با محیط زیست، و سطح ویژه بالا باشد(10-7). ویژگی های کاتالیزگر با اندازه نانو در زیر توضیح داده شده است:
- تحرک الکترون: تحرک الکترون بالا و مقاومت کمتر کاتالیزور، که باعث حرکت سریع الکترون ها از باند ظرفیت به نوار هدایت می شود و منجر به واکنش پذیری بالا در طول فعالیت فوتوکاتالیستی می شود.
- انرژی باند گپ: فاصله باند نوری وسیع نانوکاتالیست مزیتی را از نظر استفاده از نورهای UV و مرئی می دهد. علاوه بر این، فاصله باند نوری گسترده تر منجر به نوترکیبی کمتر در طول فرآیند تحریک نوری می شود.
- شفافیت: بازتاب بهتر و شفافیت نوری باال نانومواد در ناحیه مادون قرمز، مزیت کلیدی برای تابش نور است.
ویژگی های فوتوکاتالیزوری نانو مواد
- حساسیت به نور: حساسیت به نور بالای اکسیدهای فلزات نیم رسانا باعث استفاده بهتر از تابش نور برای تولید الکترون ها وحفره ها می شود.
- پایداری: برای فرآیند حذف رنگ از فاضالب، کاتالیزگر باید از نظر ترمودینامیکی، شیمیایی و در برابر فوتون پایدار باشد.
- بی اثری شیمیایی و بیولوژیکی: کاتالیزگر باید از نظر شیمیایی و بیولوژیکی بی اثر باشد. این باعث می شود بدون واکنش کاتالیزگر با مواد شیمیایی و گونه های بیولوژیکی موجود در واکنش، سرعت واکنش افزایش یابد.
- غیر سمی: کاتالیزگر نباید هیچ گونه اثر نامطلوبی بر اکوسیستم داشته باشد و نباید توسط انسان، گیاهان و جانوران زیاد جذب شود.
- ضد فتو خوردگی: کاتالیزگرها نباید آلاینده و لجن ثانویه به دلیل خوردگی نور ایجاد کنند.
- مساحت سطح ویژه: در دسترس بودن سطح وسیعی از نانوذرات منجر به فعالیت فوتوکاتالیزوری بالای فوتوکاتالیزگر می شود که دلیل آن وجود مکان های فعال تر برای جذب مولکول های رنگ است.
هنگامی که اندازه کاتالیزگرها از ابعاد میکرو به ابعاد نانوکاهش می یابد، خواص فوق به شدت بهبود می یابد. به خصوص فعالیت فوتوکاتالیزوری کاتالیزگر به دلیل مساحت سطح بالا، در دسترس بودن رادیکال های بیشتر، انتقال جرم بهتر مولکول های واکنش دهنده، تسهیل انتشار و وجود نقص هایی مانند فضای خالی اکسیژن یا بینابینی فلزی افزایش می یابد(6-7).
- نانومواد مبتنی بر اکسید فلزات واسطه
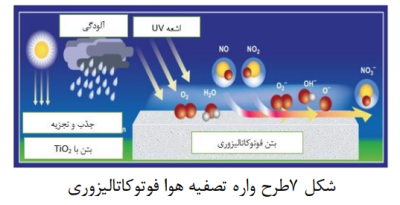
اخیراً محققان به دو دلیل عمده بر روی نانومواد مبتنی بر اکسید فلزات واسطه به عنوان کاتالیزگر کار می کنند. اول اینکه دارای خواص الکترونیکی . نوری . حرارتی . شیمیایی و مکانیکی مناسبی هستند و ثانیاً خواص مواد را می توان به راحتی تغییر داد . همچنین دارای ظرفیت انتشار بالا . فراوانی. تعداد زیاد سایت های فعال,واکنش پذیری شیمیایی بالا و فاصله باند و خواص انتقال بار بالاتر می باشند که آنها را به یک نامزد بالقوه برای فعالیت فوتوکاتالیزوری کارآمد در جهت تخریب تبدیل می کند. ترکیب رنگ های آنیونی و کاتیونی. نانومواد مبتنی بر نیم رساناها دارای انرژی باند گپ مناسبی هستند(14) تصفیه هوا خروجی وسایل نقلیه بر کیفیت هوا تأثیر منفی می گذارد. این تاثیر ناشی از اکسیدهای نیتروژن، هیدروکربن ها و مونوکسید کربن میباشد. واکنش های فتوشیمیایی در اثر فعالیت نور خورشید روی2NO وترکیبات آلی فرار منجر به تشکیل مه دود فتوشیمیایی و ازن می شود. اینها آلاینده های ثانویه دور برد هستند که بر مناطق روستایی که اغلب دور از سایت انتشار هستند تأثیر می گذارند. فوتوکاتالیز ناهمگن یک استراتژی امیدوارکننده برای کاهش NOx است. فوتوکاتالیزور2TiO به طور موثری آلاینده ها را در حضور نور تجزیه می کند. شکل 7 تصفیه هوا را از طریق فوتوکاتالیز نشان می دهد(28-30).
- چالش های فوتوکاتالیزور های نیم رسانا
در دهه های اخیر، پژوهشگران بر واکنش هایی که روی سطوح اکسیدهای فلزی نیم رسانا، سولفیدها و سلنیدها که دارای شکاف باند متوسطی با اختالف انرژی 1/3-1/8 eVبین باندهای ظرفیت و هدایت می باشد، تمرکز کرده اند. تواناترین مواد فوتوکاتالیزوری موجود، اکسیدهای فلزی 2TiO و ZnO هستند. سولفیدهای فلزات و سلنیدهای فلزی به دلیل خوردگی فوتوآندی و سمیت، پایدار نیستند. برخی از مواد مانند 3O2Fe، 3WO و 2MoS پتانسیل ردوکس پایینی دارند. هنوز در بحث فوتوکاتالیزوری، چالش های زیادی مانند جداسازی حامل های بار، مساحت سطح، سطوح قابل تنظیم شیمی، انرژی نور قابل استفاده و ماهیت گونه های فعال اکسیژن وجود دارد. ناکاتا و همکاران نشان دادند که وقتی (3.32 eV)با سایر اکسیدهای فلزی در تماس قرار میگیرد؛ بهره وری آن بهبود مییابد و به علت راندمان کوانتومی، استحکام بالا در محیط سیال و ماهیت غیر سمی، کاندیدای خوبی برای فرآیند فوتوکاتالیزوری میباشد(18). اکسیدهای فلزی 2TiO و ZnO دارای سطوح پتانسیل خوبی هستند، اما متأسفانه بازده آنها به دلیل غیرفعال بودن در زیر نور مرئی در اثر باند گپ زیاد آنها پایین است.
هماتیت همچنین یک ماده فوتوکاتالیزوری خوب است زیرا جذب آن در ناحیه مرئی قابل مشاهده است. در مقایسه با ZnO یا 2TiO، 3O2Fe بازده فوتوکاتالیستی کمتری را به علت خواص خورندگی آن و ایجاد حالت های انتقال بار فلز به لیگاند یا لیگاند به فلز با عمر کوتاه از خود نشان میدهد. تصمیمات جهانی برای استفاده از نور خورشید در حفاظت از محیط زیست، تصفیه آب و تولید انرژی درحال انجام است. نور خورشید شامل حدود 5 تا 7 درصد نور فرابنفش، 46 درصد نور مرئی و 47 درصد اشعه مادون قرمز میباشد. از این رو، رویکردهای فنی مختلف برای جذب فوتون های با انرژی پایین تر و افزایش کارایی نیمه هادی های 2TiO و ZnO در حال بررسی است. محققین همواره برای افزایش کارایی این مواد، به ویژه در زیر نور مرئی درحال تحقیق و بررسی بوده اند.
- بحث و نتیجه گیری
این مقاله به بررسی فوتوکاتالیز و مکانیسم های اکسیداسیون و کاهش پرداخته است.همانطور که بحث شد، تعدادی از پارامترهای فیزیکی بر فعالیت فوتوکاتالیزوری مواد تأثیر می گذارند.این ها شامل pH محلول، شدت نور، غلظت اولیه آلاینده ها، دمای واکنش و جرم کاتالیزگر میباشد؛ باند گپ ونوترکیبی الکترون-حفره فرآیند فوتوکاتالیز را محدود می کند. هر فوتوکاتالیزگر دامنه وسیع کاربردی می تواند داشته باشد.به عنوان مثال، 2TiO به علت حل نشدن و پایداری آن، بیشترین استفاده از فوتوکاتالیزگر در کاربردهایی از جمله شکافت آب، تولید هیدروژن و تجزیه زیستی را دارا میباشد. فوتوکاتالیز همچنین راه هایی را برای تصفیه هوا با کمک اکسیدهای فلزی مختلف (نیمه رساناها) که تحت تأثیر اشعه ماوراء بنفش فعال می شوند را فراهم میکند. برای غلبه بر چالش ها و دستیابی به کارایی بالاتر زیر نور مرئی، تحقیقات بیشتری مورد نیاز است.
- منابع
[1] Xiaodong Sun, Shuaiyu Jiang, Hongwei Huang, Hui Li, Baohua Jia, Tianyi Ma, Solar Energy Catalysis, Angewandte, Volume61, Issue29, July 18, 2022 ,e202204880
[2] N.S. Lewis, D.G. Nocera, Powering the planet: chemical challenges in solar energy utilization, Proc. Natl. Acad. Sci. 103 (43) (2006) 15729–15735.
[3] J.-P. Becker, et al., A modular device for large area integrated photoelectrochemical watersplitting as a versatile tool to evaluate photoabsorbers and catalysts, J. Mater. Chem. A 5 (10) (2017) 4818– 4826.
[4] N.S. Lewis, Research opportunities to advance solar energy utilization, Science 351 (6271) (2016). p. aad1920.
[5] S. Kuravi, et al., Thermal energy storage technologies and systems for concentrating solar power plants, Prog. Energy Combust. Sci. 39 (4) (2013) 285– 319.
[6] Mohammadzadeh Kakhki R, Tayebee R, Ahsani F (2017) New and highly efficient Ag doped ZnO visible nano photocatalyst for removing of methylene blue. J Mater Sci Mater Electron 28:5941–5952. doi: 10.1007/s10854- 017-6593-7
[7] Mohammadzadeh Kakhki R, Karimian A, Hasan-nejad H, Ahsani F (2019) Zinc oxide– nanoclinoptilolite as a superior catalyst for visible photo-oxidation of dyes and green synthesis of pyrazole derivatives. J Inorg Organomet Polym Mater 29:1358–1367
[8] Mohammadzadeh Kakhki R, Tayebee R, Hedayat S (2018). Phthalhydrazide nanoparticles as new highly reusable organic photocatalyst in the photodegradation of organic and inorganic contaminants, Appl Organomet Chem 32: e4033.
[9] Mohammadzadeh Kakhki R, Khorrampoor A, Rabbani M, Ahsani F (2017) Visible light photocatalytic degradation of textile waste water by Co doped NiFe2O4 nanocomposite,J Mater Sci Mater Electron 28:4095–4101.
[10]Mohammadzadeh Kakhki R, Mohammadpoor M, Faridi R, Bahadori M (2020) The development of an artificial neural network – genetic algorithm model (ANN-GA) for theadsorption and photocatalysis of methylene blue on a novel sulfur–nitrogen co-doped Fe2O3 nanostructure surface RSC Adv. 10:5951–5960.
[11] Mohammadzadeh Kakhki R, Hedayat S, Mohammadzadeh K (2019) Novel, green and lowcost synthesis of Ag nanoparticles with superior adsorption and solar based photocatalytic activity, J Mater Sci Mater Electron 30:8788–8795.
[12] Mohammadzadeh Kakhki R, Ahsani F, Mir N (2016) Enhanced photocatalytic activity of CuO–SiO2 nanocomposite based on a new Cu nanocomplex, J Mater Sci Mater Electron 27:11509–11517. doi: 10.1007/s10854-016- 5175-x
[13] Tayebee R, Mohammadzadeh Kakhki R, Audebert P, Amini MM, Salehi M (2018) A robust UV–visible light‐driven SBA‐15‐ PS/phthalhydrazide nanohybrid material with enhanced photocatalytic activity in the photodegradation of methyl orange, Appl Organomet Chem 32: e4391
[14] Mohammadzadeh Kakhki R, Ahsani F (2018) New and effective ZnO and Zn3(VO4)2 visible nano photocatalysts with enhanced photocatalytic performance, J Mater Sci Mater Electron 29:3767–3774.
[15] Mohammadzadeh Kakhki R, Ahsani F (2020) Development of a novel and high performance visible‐light‐induced Cd3OSO4 nanophotocatalyst for degradation of diazinon, Appl Organomet Chem 34: e5770
[16] Yaghoobi Rahni S, Mohammadzadeh Kakhki R (2020) Facile and green synthesis of Cu3V2O8 nanostructures via Moringa peregrina natural extract as a high-performance photo catalyst, Appl Organomet Chem 34: e5392.
[17] R. Mohammadzadeh Kakhki, R. Tayebee, F. Ahsani, J. Mater.Sci.: Mater. Electron. 28, 5941 (2017)
[18] K. Nakata, A. Fujishima, TiO2 photocatalysis: design and applications, J Photochem Photobiol C: Photochem Rev 13 (3) (2012) 169–189.
[19] D. Chatterjee, S. Dasgupta, Visible light induced photocatalytic degradation of organic pollutants, J Photochem Photobiol C: Photochem Rev 6 (2–3) (2005) 186–205
[20] R. Saravanan, F. Gracia, A. Stephen, Basic principles, mechanism, and challenges of photocatalysis, in: M. Khan, D. Pradhan, Y. Sohn (Eds.), Nanocomposites for Visible LightInduced Photocatalysis, Springer Series on Polymer and Composite Materials, Springer, Cham, 2017, pp. 19–40.
[21] N.P. Thao, et al., Role of ethylene and its cross talk with other signaling molecules in plant responses to heavy metal stress, Plant Physiol. 169 (1) (2015) 73–84.
[22] S. Malato, et al., Decontamination and disinfection of water by solar photocatalysis: recent overview and trends, Catal. Today 147 (1) (2009) 1–59.
[23] K. Rajeshwar, et al., Heterogeneous photocatalytic treatment of organic dyes in air and aqueous media, J Photochem Photobiol C: Photochem Rev 9 (4) (2008) 171–192.
[24] H. Ahmad, et al., Hydrogen from photocatalytic water splitting process: a review, Renew. Sustain. Energy Rev. 43 (2015) 599–610.
[25] Z. Li, X. Meng, Z. Zhang, Recent development on MoS2-based photocatalysis: a review, J Photochem Photobiol C: Photochem Rev 35 (2018) 39–55.
[26] J. Theerthagiri, et al., Recent advances in MoS2 nanostructured materials for energy and environmental applications—a review, J. Solid State Chem. 252 (2017) 43–71.
[27] J.C. Colmenares, et al., Nanostructured photocatalysts and their applications in the photocatalytic transformation of lignocellulosic biomass: an overview, Materials 2 (4) (2009) 2228–2258.
[28] A. Beeldens, Air purification by pavement blocks: Final results of the research at the BRRC, 2008.
[29] P. UNION, Directive 2008/50/EC of the European Parliament and of the Council of 21 May 2008 on Ambient Air Quality and Cleaner Air for Europe, Official Journal of the European Union 2008.
[30] E. Boonen, A. Beeldens, Recent photocatalytic applications for air purification in Belgium, Coatings 4 (3) (2014) 553–573.

