
Blog
محلول سازی

محلول سازی چیست؟
محلول سازی یکی از مهمترین مباحث و مقدمات آزمایشگاه است که شما در انجام تستهای مختلف کار با کیت ها و دستگاه های آزمایشگاهی و غیره با آن سر و کار دارید.
تعاریف:
برای تهیه ی محلولی با غلظت مشخص از ماده ی مورد نظر لازم است تا مقدار مشخصی از مول حل شونده را در حلال مورد نظر حل نمایید تا به حجم نهایی برسد. پیش از توضیحات و پرداختن به چگونگی محلول سازی به مفاهیم کلی از آن می پردازیم:
مول:
مول یک واحد اندازه گیری برای ترکیباتی از قبیل اتم، مولکول و یا سایر ذرات مشخص شده است. یک مول دارای 6.02214076 × 1023 اتم می باشد جالب است بدانید تعداد اتم ها در یک مول برای همه ی مواد یکسان است
به عنوان مثال کربن 12 دارای 6.02214076 × 1023 اتم و جرم 12 می باشد. اکسیژن نیز دارای همین مقدار اتم و جرم 5.999 است . بنابراین اکسیژن جرم بیشتری نسبت به کربن دارد. این استدلال همچنین می تواند بر وزن مولکولی نیز اعمال شود.
مولاریته:
مولاریته غلظت محلول را بر اساس مقدار مواد حل شونده در یک لیتر حلال بیان می کند. برای به دست آوردن مقدار مولاریته، مقدار مول را بر حجم تقسیم می نمایند.
برای محاسبه ی مولازیته 3 مرحله ی زیر را باید به ترتیب انجام دهید:
اندازه گیری تعداد مول های ماده ی حل شونده
حجم موجود را بر اساس لیتر محاسبه نمایید
در نهایت تعداد مول ها را بر حجم تقسیم نمایید تا مولاریته به دست آید.
به مثال زیر توجه نمایید:
مولاریته ی محلول حاوی 15 گرم سود پرک در حجم 225 میلی لیتر چقدر است؟
پاسخ:
جرم 1 مول سدیم هیدروکسید (سود مایع و سود پرک) برابر با 40 گرم می باشد. در نتیجه:

نرمالیته:
نرمالیته به صورت تعداد اکی والان مول در هر لیتر محلول تعریف می شود. نرمالیته مانند مولاریته به مقدار حل شونده در حلال اشاره دارد. اما باید توجه نمود که نرمالیته به طور غالب برای اسید ها و باز ها به کار می رود.
چگونگی محاسبه ی نرمالیته از مولاریته؟
مول اکی والان از اسید و باز با محاسبه ی یون های H+ یا OH- در هر مولکول محاسبه می شود:
N = n × M
(n عدد صحیح است)
برای محلول اسیدی n تعداد یون های H + موجود در اسید است. به عنوان مثال محلول 3M اسید فسفریک (H3PO4) دارای نرمالیته ی 9 می باشد.
برای محلول بازی n تعداد یون های هیدروکسیل می باشد. به عنوان مثال غلظت محلول 1M Ca(OH)2 برابر با 2نرمال می باشد
نکته: نرمالیته ی محلول هرگز پایین تر از مولاریته نیست
استوکیومتری:
استوکیومتری یکی از راه های حل مسائل شیمی می باشد که معمولا برای محلول سازی از آن کمک گرفته می شود. معمولا با این روش می توان جرم را به مول تبدیل کرد ، نسبت های واکنش را یافت و دیگر نقاط گمنام موجود در واکنش را یافت. برای حل مسائل استوکیومتری لازم است تا معادله حتما موازنه شده باشد. در ادامه به حل مسائل با این روش بیشتر می پردازیم.
محلول:
محلول یک مخلوط همگن است که از حل نمودن 1 یا 2 حل شونده در حلال به دست می آید. ماده ی شیمیایی کمتر (حل شونده) در ماده ی شیمیایی بیشتر (حلال) حل می گردد. محلول هایی با غلظت معلوم را به عنوان محلول های استاندارد در نظر می گیرند. محلول های استاندارد را می توان مستقیما از تولید کننده خریداری نمود و یا با محلول سازی مقداری مشخص از حل شونده را در حجم مشخصی از حلال حل نمود.
باید توجه نمود پیش از شروع به محلول سازی با غلظت معین در ابتدا شما باید محاسبات لازم را انجام دهید. به عنوان مثال اول باید مشخص کنید که محلول چند مولار می خواهید بسازید و سپس مقدار حل شونده را با ترازو وزن نمایید.
برای ساخت محلول با غلظت معلوم از فرمول زیر کمک می گیرند:
گرم ماده ی مورد نظر =(جرم مولکولی/1مول)* (مقدار مولی که می خواهید بسازید/حجم 1000میلی لیتر)* حجم مورد نظر
مثال: ساخت 100 میلی لیتر محلول 1 مولار سدیم هیدروکسید، از سدیم هیدروکسید خالص:
جرم مولکولی سدیم هیدروکسید=40g/mol
جرم سدیم هیدروکسید که باید با ترازو وزن نماییم= 40g/mol)*(1mol/1000ml)*100ml)
در نتیجه مقدار 4 گرم از این ماده لازم است، سپس با به حجم رساندن تا 100 میلی لیتر به محلول 1 مولار خواهیم رسید.
محلول سازی از مواد جامد به دو روش ساده انجام می شود:
روش اول:
در روش اول ماده ی جامد که پیش از این مقدار آن را محاسبه نموده اید با یک کاغذ و یا در یک ظرف کوچک توزین می گردد. سپس ماده ی جامد را به درون بالن انتقال می دهید و مقداری حلال به آن اضافه می کنید و ظرف را تکان می دهید تا حل شونده به طور نسبی در حلال حل شود. سپس حلال را به مقدار کافی به بالن اضافه می کنید تا محلول ساخته شده به خط نشانک موجود بر روی بالن برسد.
روش دوم:
روش دوم نیز همانند روش اول است با این تفاوت که در روش دوم مقدار جامد را در یک بشر وزن نموده اید و در ابتدا حل شونده را در حلال حل کرده اید. سپس محلول را به بالن مورد نظر انتقال می دهید و مجددا با کمک حلال به خط نشانک بالن می رسانید. یکی از معایب این روش این است که ممکن است محلول سازی دقیق صورت نگیرد و مقداری حل شونده در دیواره های بشر باقی بماند.
اما برای مایعات چگونه محلولی با غلظت مشخص بسازیم؟
در محلول سازی مایعات (روش وزنی) در ابتدا بشر را وزن می نمایید. سپس ترازو را صفر کرده و طبق محاسبات صورت پذیرفته مقدار حل شونده ی مورد نظر را وزن می نمایید. حل شونده را به بالن انتقال می دهیم و با کمک حلال به حجم مورد نظر می رسانیم.
در روش حجمی شما مقدار حجم محلول را با کمک فرمول (Mمحلول اولیه*V محلول اولیه= Mحل شونده *V حل شونده) محاسبه می نمایید. سپس با کمک پیپت حجم مشخصی از حل شونده را که طبق فرمول فوق الذکر به دست آمده است از محلول مادر (محلول اولیه) جدا و به بالن انتقال می دهید و در نهایت با کمک حلال مورد نظر تا خط نشانک بالن به حجم می رسانید.
نکات محلول سازی:
در شکل زیر به محلول سازی آمونیوم دی کرومات با اتانول می پردازیم . از آنجایی که حل شونده در حلال حل می گردد همیشه حجم حلال مورد نیاز کمتر از حجم در نظر گرفته شده خواهد بود. به عنوان مثال شما برای ساخت 1 لیتر از محلول آمونیوم دی کرومات به دقیقا 1 لیتر اتانول احتیاج نخواهید داشت. بنابراین لازم است شما ابتدا مقدار حل شونده را در بالن مورد نظر بریزید و سپس تا خط نشانک به آن حلال بیافزایید.

همانطور که در شکل فوق نیز مشاهده می شود با اندازه گیری 90 گرم از آمونیوم دی کرومات ، کمتر از 250 میلی لیتر برای ساخت این محلول در بالن 250 میلی لیتری نیاز خواهد بود.
چگونه محلول 1 درصد بسازیم؟
محلول 1 درصد به حل نمودن 1 گرم از ماده در 100 میلی لیتر آب اشاره دارد. در نتیجه برای ساخت محلول 1 درصد تنها کافی است 1 گرم از ماده را وزن نمایید و به حجم 100 میلی لیتر برسانید
مسائل؟!:
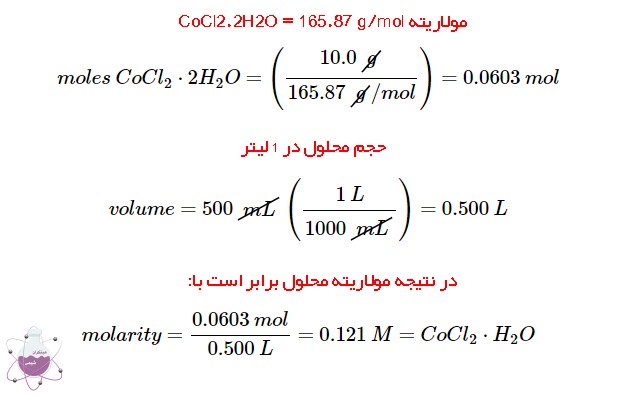
اگر محلول ساخته شده حاوی 10 گرم کبالت کلرید دی هیدرات در مقدار کافی اتانول در بالن 500 میلی لیتری باشد مقدار غلظت CoCl2·2H2O در محلول چقدر است؟
پاسخ:
برای پیدا کردن مقدار CoCl2·2H2O جرم ماده را بر جرم مولی آن تقسیم کنید. با تقسیم نمودن مقدار مول حل شونده بر حجم موجود می توان مولاریته ی ماده را محاسبه نمود.
مولاریته CoCl2·2H2O= 165.87 g/mol.
بنابراین:
سوال؟ محلول D5W حاوی 0.310 مولار گلوکز است. ( D5W تقریباً حاوی 5٪ محلول دکستروز [نام پزشکی گلوکز] در آب است). جرم گلوکز مورد نیاز برای تهیه یک کیسه 500 میلی لیتری D5W را محاسبه کنید. گلوکز جرم مولی برابر با 180.16 گرم در مول دارد.
پاسخ:
در مرحله ی اول مقدار مول های گلوکز موجود در محلول را با ضرب کردن حجم محلول در مولاریته ی آن به دست می آوریم.
در مرحله ی دوم جرم گلوکز مورد نیاز را با ضرب کردن تعداد مول ها در جرم مولی به دست می آوریم:
درنتیجه در ابتدا باید تعداد مول های گلوکز موجود در 500 میلی لیتر از محلول 0.310 M را محاسبه کنیم:
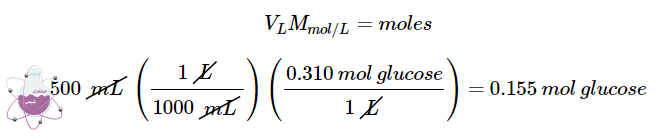
سپس مقدار مول های گلوکز را به جرم آن تبدیل می کنیم:
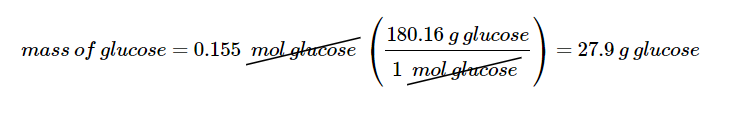
محلول سازی از ماده اولیه
در محلول سازی فرمول MdVd=MsVs نیز مورد استفاده قرار می گیرد در این فرمول می توان به رابطه ی بین محلول مادر (اولیه) و محلول دختر( محلول رقیق شده) اشاره نمود.
به مثال زیر توجه نمایید:
سوال؟
برای تهیه 2500 میلی لیتر محلول D5W در مثال 4 چه میزان از محلول گلوکز 3.00 M لازم است؟
- راه حل:
مرحله ی اول: در مرحله ی اول تعداد مول های گلوکز موجود در محلول رقیق را با ضرب کردن حجم محلول در مولاریته آن می توان به دست آورد:
در مرحله ی دوم: برای تعیین حجم ماده ی مورد نیاز تعداد مول های گلوکز را بر مولاریته ی محلول تقسیم می نماییم. پاسخ:
در محلول D5W طی مثال 4 مقدار مولاریته ی گلوکز 0.310 M بود. در این مرحله تعداد مول های گلوکز موجود در 2500 میلی لیتر از محلول را محاسبه می کنید:
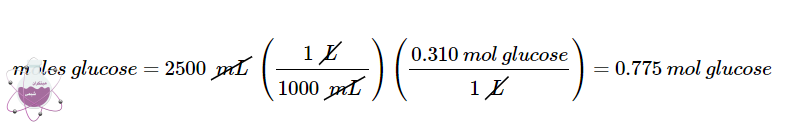
سپس حجم محلول 3 مولار محلول مادر را که حاوی این مقدار گلوکز است را محاسبه می نماییم
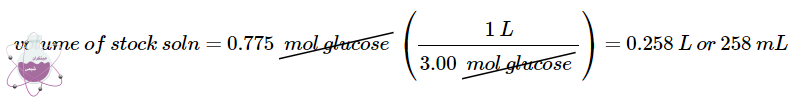
برای اندازه گیری حجم محلول مادر مورد نیاز تعداد مول های گلوکز را بر غلظت محلول مادر تقسیم می کنیم تا مقدار مناسب به دست آید. همچنین تعداد مول های حل شونده در 258 میلی لیتر محلول مادر برابر با تعداد مول ها در 2500 میلی لیترمحلول رقیق شده است در نتیجه مقدار حلال تغییر کرده است. این مسئله معمولا اینگونه توجیح می شود که با 10 برابر رقیق کردن محلول مادر حجم آن 10 برابر می شود ( 258mL → 2500 mL). در نتیجه غلظت حل شونده در حدود 10 برابر کاهش می یابد ( 3M → 0.310 M).

سوال؟
دانش آموزی مقدار 5.00 میلی لیتر از FeCl3 با غلظت 3.47 *10-2 مولار را به بالن 250 میلی لیتری انتقال می دهد. غلظت محلول رقیق شده چقدر است؟
پاسخ
M2 غلظت محلول ثانویه
M1 غلظت اولیه
V1 حجم اولیه
V2 حجم ثانویه
M1V1=M2V2
M2=M1*V1/V2
5*3.47*10-2= 250*M2
در نتیجه M2= 6.94 x 10-4 M

