
Blog
مشهورترین نانوساختارها

۱- نانوساختارهای کربنی
الماس، گرافیت، گرافن، نانولوله کربنی از مهمترین ساختارهای کربنی هستند که ما فناوری نانو با آنها سروکارداریم. از این رو در این بخش به معرفی این ساختارهای مهم کربنی میپردازیم.
۱-۱- گرافیت
درشکل ۱ تصویری از الماس و گرافیت و نحوۀ قرارگیری اتمهای کربن در ساختار آنها را میبينيد. گرافیت سیاهرنگ، به شدت نرم، انعطافپذیر و رسانای الکتریسیته و حرارت است؛ حال آنكه الماس، کاملاً شفاف، مستحکم و انعطافناپذیراست و رسانای حرارت یا الکتریسیته نمیباشد. در هر دوی این مواد، اتمهای کربن با پیوندهای کووالانسی در کنار یکدیگر جای گرفتهاند؛ با این تفاوت که در گرافیت، اتمهای کربن از چهار پیوندی که میتوانند با اتمهای پیرامون خود برقرار کنند، سه پیوند با اتمهای کربن همسایهشان برقرار ميكنند و یک شبکة دو بعدی را تشکیل میدهند. به این نوع پیوندهای کربن در اصطلاح شیمی هیبریداسیون sp2 گفته میشود؛ در حالیکه در الماس، اتمهای کربن با داشتن هیبریداسیون sp3، هر چهار پیوند ممکن خود را با اتمهای همسایه برقرار کردهاند که حاصل آن، شبکهای سهبعدی از اتمهای کربن است. تفاوت چشمگیر خواص فیزیکی و شیمیایی این دو ماده كه از اتمهای کربن تشکیل شدهاند، از همين تفاوت تعداد پیوندها و زاویة آنها سرچشمه میگیرد. در ساختارهایی که دارای پیوندهای sp2 هستند تمامی اتمها در یک صفحه قرار گرفتهاند و زاوية بین آنها برابر °۱۲۰ است که منجر به ساختاری لایهای میشود؛ در حالی که ساختارهایی با هیبریداسیون sp3 یک شبكة سه بعدی ایجاد ميكنند و زاوية میان پیوندها برابر °۱۰۹/۵ است. در کنار الماس و گرافیت که دارای ساختار منظم و تعریف شدهاند، دوده دگرشکل دیگری از کربن است که اتمهای آن نظم و ترتیب خاصی در محل قرارگیری خود ندارند.

شکل ۱- تصویری از الماس و گرافیت و نحوة چیدمان اتمهای کربن در آنها
۲-۱- گرافن
گرافن نانو مادة دو بعدی است که همچون پیشینیان خود خواص خارقالعادهای دارد. شما پیش از این و به صورت غیر مستقیم با گرافن آشنا شدید (شکل ۱، تکلایههای کربنی در ساختار گرافیت). گرافن لایهای است متشکل از اتمهای کربن، که ضخامت آن برابر قطر یک اتم کربن است. بر این اساس، گرافن را میتوان گرافیتی با ضخامت یک اتم کربن در نظر گرفت به همين سبب، آن را نازکترین مادهای دانستهاندکه بشر تا كنون به آن دست پیدا کرده است، همچنين، مستحکمترین مادهای است که تا به حال شناخته شده است. در کنار خواص مکانیکی جالب، گرافن بهترین مادۀ رسانایی است که تاكنون مشاهده شده است. خواص عالی گرافن، محققان را به این باور رسانده است که با استفاده از آن میتوان جهان فناوری و صنعت را متحول کرد.
از گرافن به دلیل خواص مهم بسیاری که دارد، میتوان بهعنوان یک نانوساختار ویژه نام برد. این خواص شامل شفافیت نوری، رسانش الکتریکی، استحکام مکانیکی و رسانش حرارتی میشود. گرافن مادهای بسیار سبک با چگالی صفحهای ۰/۷۶۷mg.g است؛ چنین چگالی صفحهای پایینی که از ضخامت کم گرافن ناشی میشود صرفاً برابر یک اتم کربن است و به همین سبب، این نانوماده، فوق نازک و بسیار سبک میباشد.
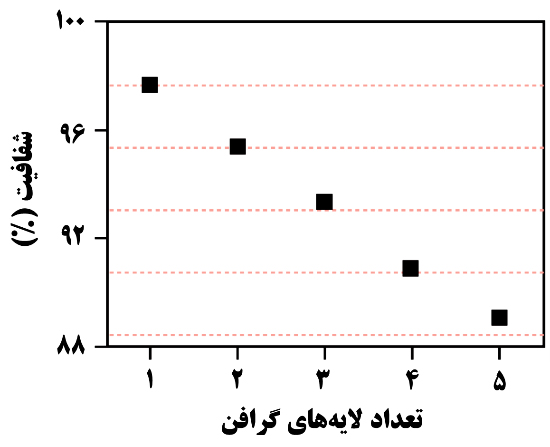
شکل ۲- شفافیت گرافن برای تابعی از تعدادلایههای گرافن
گرافن به دلیل ضخامت خیلی کمی که دارد، بسیار شفاف است؛ به طوری که شفافیت یک تکلایۀ گرافن ۹۷/۷ درصد است. همانطور که در شکل ۲ نشان داده شده تفاوت شفافیت میان یک زیرلایۀ شفاف و تکلایههای گرافن و به همین ترتیب تفاوت شفافیت میان گرافن تکلایه و دولایه ۲/۳ درصد است. بر این اساس، با توجه به روند تقریباً خطی کاهش شفافیت گرافن با افزایش تعداد لایههای آن، میتوان از شفافیت گرافن بهعنوان شاخصی برای سنجش تعداد لایههای آن بهره گرفت.
دیگر خاصیت نوری گرافن، نحوۀ شکست نور و تداخل پرتوهای نور به هنگام عبور از میان لایههای گرافن است. این امر موجب آن میشود که با افزوده شدن هر لایه به گرافن، رنگ تغییر یابد (شکل ۳). این امر در کنار شفافیت گرافن موجب میشود که بتوان بهراحتی و با تغییر تعداد لایهها به خواص نوری دلخواهی از این نانوماده دست یافت.
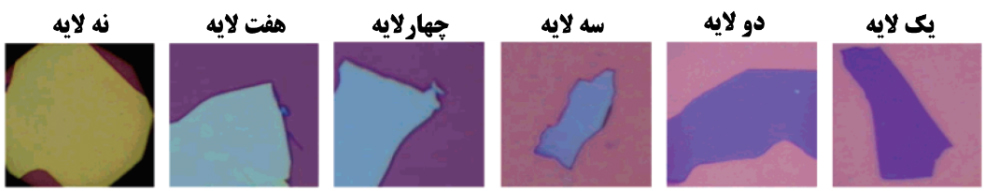
شکل ۳- تغییر رنگ ظاهری گرافن با افزایش تعداد لایههای آن
برای سنتز نانومواد گرافنی که شامل انواع تکلایههای گرافنی با ابعاد مختلف و سایر مواد گرافنی است، سه روش کلی وجود دارد: لایهلایه کردن مکانیکیگرافیت، لایهلایه کردن شیمیایی گرافیت، و رسوب بخار شیمیایی (CVD). هر یک از این روشها مزیت خاص خود را دارد و برای دستيابي به نوع خاصی از گرافن یا نانومواد گرافنی به کارمی رود.
امروزه از مواد مختلف کربنی که ساختار لایهای دارند، با عنوان گرافن یاد میشود. با وجود این، انواع نانومواد شامل پودرهای گرافن اکسید (GO)، گرافن اکسید انبساط حرارتی (TEGO)، گرافن اکسید احیا شده (RGO)، نانوصفحههای گرافن، نانوروبانهای گرافن و نقاط کوانتومی گرافن (GQD) در دستة نانومواد گرافنی قرار میگیرند. این نانومواد ساختار لایهای دارند. با وجود این، بسیاری از آنها از چندین لایه تشکیل شدهاند.
امروزه نانومواد گرافنی در زمینههای مختلفی از فناوری و علم کاربردهای فراوانی دارند؛ به طوری که میتوان گفت کاربردهای آنها از خود گرافن وسیعتر است. چنین کاربردهایی نهتنها به دلیل خواصی است که این نانومواد از گرافن به ارث بردهاند بلکه از مشخصههایی ناشی میشود که آنها به دلیل ابعاد، تعداد لایهها و ترکیب شیمیایی سطحی متفاوت و اصلاح شده در مقایسه با گرافن دارند.
از گرافن بهعنوان نانومادهای نام برده میشود که موجب انقلابی در فناوریهای مختلف شده است. در حال حاضر کاربردهای متنوع گرافن را میتوان در حوزههای مختلف فناوری به شش بخش اصلی تقسیم کرد: صنایع الکترونیک، نانوحسگرها، نور و اپتیک، پزشکی و داروسازی، محیط زیست و انرژی. با وجود این، همه روزه کاربردهای تازۀ گرافن یا نانومواد گرافنی در بخشهای مختلف صنعت و فناوری معرفی میشود.
۳-۱- نانولوله کربنی
نانولوله کربنی (CNT)، ساختار لولهای و توخالی دارد. برای تصور نحوۀ شکلگیری یک نانولوله کربنی ساده، اتمهای کربن را در ساختاري صفحهای، مشابه آنچه در گرافیت وجود دارد، تصور کنید که به هم پیچیده است و لولهای توخالی را شکل داده است (شکل ۴). باید توجه داشت که در عمل، نانولولههای کربنی از طریق لولهکردن لایهای از اتمهای کربن شکل نمیگیرند و فرایندهای ویژهای برای تولید آنها وجود دارد. اين نانولولهها خواص بسیار جالب توجهی دارند که استحکام بالا و رسانایی الکتریکی و حرارتی از جملة آنهاست. این خواص بسیار عالی در قیاس با مواد تودهای متداول، کاربردهای فراوانی برای این نانومواد یک بعدی ایجاد کرده است. قطر نانولولهها کربنی در بازۀ ۰/۴ تا ۴۰ نانومتر است و نسبت طول به قطر آنها میتواند تا چندین میلیون برسد. برای مثال، گزارشهای مبنی بر سنتز نانولولههای کربنی با طول بیش از ۱۰cm نیز وجود دارد.
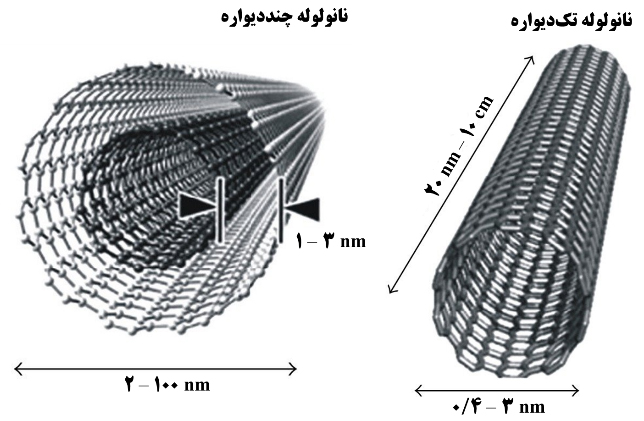
4- تصویری از ساختار نانولولههای تکدیواره و چنددیواره و برخی مشخصات ساختاری آنها
نانولولهها از نظر تعداد لایههای تشکیلدهندۀ ديوارهشان به طور کلی به دو دسته تقسیم میشوند: تکدیواره و چنددیواره. نانولولههای تکدیواره را میتوان همچون ورقهای لوله شده از یک صفحه گرافن تصور کرد. نانولولههای چنددیواره نیز از درون هم قرار گرفتن چند نانولولۀ تکديواره هممرکز بهوجود میآیند.
نانولولههای کربنی از نظر شکل ظاهری، انواع مختلفی دارند. آنها میتوانند، دارای انتهای باز یا انتهای بسته باشند. اینگونه تفاوتهای ظاهری به تفاوتهای چشمگیری در خواص نانولولهها منجر میشود. اگر فرض کنیم که یک نانولولۀ کربنیِ تکدیواره حاصلِ پیچش و لولهای شدن یک صفحۀ گرافن است، زاویهای که این صفحه پیچیده شده و قطر نانولولۀ حاصل، از مهمترين عوامل تأثیرگذار بر ظاهر نهایی و خواص فیزیکی نانولوله به حساب میآید. این تأثیر به حدی است که دانشمندان نانولولههای کربنی تک دیواره را بر اساس شکل لبۀ آنها که نشاندهندۀ نحوۀ پیچخوردن صفحة گرافن است، به سه دسته کلی تقسیم کردهاند: زیگزاگ، دسته صندلی و نامتقارن. شکل این سه نوع از نانولوله ها در شکل (۵) ارائه شده است.
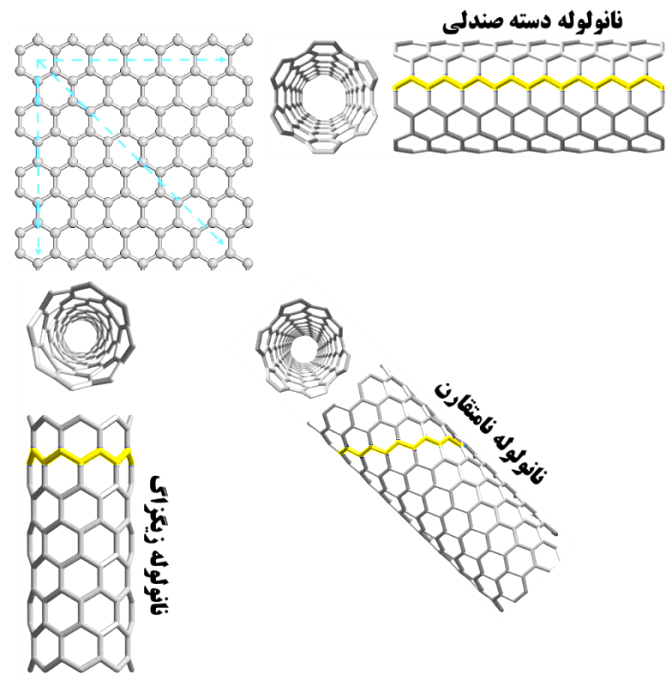
شکل ۵- انواع نانولولههای کربنی بر حسب نحوۀ پیچیده شدن صفحة کربنی
بررسی دقیق ساختار نانولولههای کربنی که بتواند خواص آنها را بهطور دقیق پیشبینی کند، نیازمند محاسبات پیچیدهای است. با وجود روش ساده شدهای که از این محاسبات حاصل آمده است، امکان بررسی ساختار نانولولهها را فراهم میکند. این محاسبات بر مبنای روابط هندسی و برخی مشخصههای ظاهری بنا شده است که در نهایت به تقریب به نسبت دقیقی از خواص الکترونیکی نانولولههای کربنی منجر میشود. برای بررسی هندسی نانولولههای کربنی، دستگاه مختصاتی مبتنی بر صفحهای متشکل از اتمهای کربنی که با ساختار لانهزنبوری کنار هم قرار گرفتهاند (شکل ۶)، تعریف شده است. چنین صفحهای متشکل از واحدهای ششضلعی است. در محاسبات هندسی نانولولههای کربنی، نکتۀ ضروری برای جلوگیری از بروز اشتباه، توجه به راستای صحیح دستگاه مختصات است.
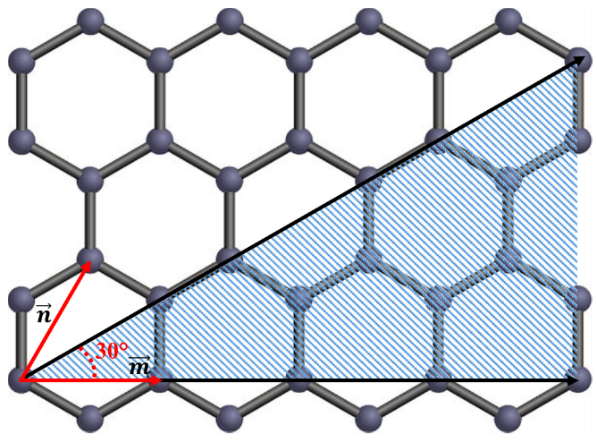
شکل ۶- نمایش محل وقوع بردار کایرال به دلیل شرط m ≥ n
با در نظر گرفتن دو نقطه در این صفحه میتوان یک بردار بین آن دو رسم کرد. با پیچش صفحة کربنی، به طوری که در پایان این دو نقظه بر هم منطبق گردند، یک نانولولۀ کربنی شکل خواهد گرفت. چنین برداری که نشان دهنده نحوۀ پیچش صفحۀ کربنی است، بردار کایرال (بردار رسم شده با خط مشکی در شکل ۶) نام دارد و به زاوية آن با محور افقی (راستای بردار یکۀ m)، زاوية کایرالگفته میشود. برای استفاده از چنین مختصاتی در محاسبات نانولولههای کربنی شرط m ≥ n ≥ 0 را در نظر میگیریم که باعث میشود بردارهای کایرال انتخابشده با مختصات (m, n)، همواره در نیمۀ پایینی صفحۀ مختصات قرار داشته باشند و بردارهای تکراری نیمۀ بالایی حذف شوند. بنابراین، بردار کایرال هر نوع نانولولۀ تکجدارهای قطعاً در قسمت هاشورخورده درشکل ۶ قرار خواهد گرفت و زاویۀ کایرال آن نیز همواره کمتر از °۳۰ خواهد بود.
با توجه به پیشفرضهای مطرح شده، مختصات هر یک از سه نوع نانولولۀ کربنی تک جداره به صورت زیر در این دستگاه مختصات کربنی قابل تعریف است:
نانولوله زیگزاگ: در صورتی که مؤلفۀ n بردار کایرال برابر صفر باشد، نانولولۀ زیگزاگ شکل میگیرد. در این صورت، زاوية کایرال برابر صفر درجه و بردار کایرال به شکل کلی (0 ,m) خواهد بود (شکل ۷-الف).
نانولوله دسته صندلی: در صورتی که دو مؤلفۀ بردار کایرال با یکدیگر برابر باشند (m = n)، نانولولۀ دسته صندلی شکل میگیرد. در این صورت، زاوية کایرال برای نانولولههای دسته صندلی برابر ۳۰ درجه خواهد بود (شکل ۷-ب).
نانولوله نامتقارن: در سومین حالت که دو مؤلفۀ بردار کایرال با یکدیگر برابر نیستند (m ≠ n)، نانولولههای نامتقارن شکل میگیرند. زاوية کایرال برای نانولولههای نامتقارن بین ۰ تا ۳۰ درجه خواهد بود (شکل ۷-ج).

شکل ۷- الف- پیچش صفحه کربنی در راستای بردار یکه و ایجاد نانولولۀ زیگزاگ. ب- پیچش صفحه کربنی در راستای (m, m) و ایجاد نانولولۀ دسته صندلی. ج- پیچش صفحه کربنی در راستای (m, n) وایجاد نانولولههای نامتقارن
۱-۳-۱- خواص نانولولههای کربنی
یکی از مهمترين خواص نانولولههای کربنی که موجب کاربرد فراوان آنها در صنایع مختلف شده، خواص مکانیکی عالی این نانولولههاست. نانولولههای کربنی به دلیل وجود پیوندهایی با هیبریداسیون sp2 میان اتمهای کربن، مستحکمترین مادۀ شناختهشده از نظر استحکام کششی محسوب میشوند.
نانولولههای کربنی علاوه بر استحکام بالا، چگالی پایینی دارند و بسیار سبکاند. بههمین ترتیب، نانولولههای کربنی از استحکام ویژۀ بالایی برخوردارند؛ بهطوری که نانولولههای کربنی چنددیواره تا به امروز، بالاترین استحکام ویژه را در میان مواد مختلف داشتهاند. به این ترتیب که نانولولههای کربنی استحکام ویژهای در حدود این به معنای آن است که استحکام کششی نانولولههای کربنی بیش از ۳۰۰ بار از فولاد بیشتر است.
به سبب پیوندهای sp2 که موجب خواص مکانیکی عالی نانولولههای کربنی میشوند، این گروه از نانوساختارهای کربنی در کنار خواص مکانیکی جالب خود، خواص الکتریکی منحصر به فردی نیز دارند. در کنار پیوندهای sp2 آنچه موجب خواص جالب الکترونیکی نانولولههای کربنی میشود، ساختار یکبعدی و توخالی آنهاست. این ساختار موجب میشود الکترونها در راستای محور لوله براحتی بتوانند جریان یابند؛ چنین حرکتی در اصطلاح ترابرد بالستیک الکترون نامیده میشود. این در حالی است که ساختار یکبعدی نانولولهها، جریان الکترونها در راستایی غیر از راستای محور اصلی را محدود میکنند و در نتیجه، رسانایی صرفاً در جهت محور نانولولهها مقدور است.
وجود الکترونهای آزاد در ساختار نانولولههای کربنی موجب آن میشود که نانولولههای کربنی دارای شکاف انرژی از صفر تا ۲eV باشند. نانولولههای تکدیوارۀ دسته صندلی رسانای الکتریسیته و نانولولههای تکدیواره زیگزاگ نیمهرسانا هستند. برای قضاوت در بارۀ رسانایی الکتریکی نانولولههای نامتقارن لازم است از اطلاعات مربوط به بردار کایرال کمک بگیریم. این مؤلفهها حاوی اطلاعات مهمی در بارۀ رفتار الکترونیکی نانولولههای نامتقارن هستند؛ به عنوان یک معیار کلی، نانولولههایی که اختلاف مولفۀ m و n آنها مضرب صحیحی از ۳ باشد و n مخالف صفر باشد، خواص نیمهرسانایی با شکاف انرژی بسیار کوچک از خود نشان میدهند. سایر نانولولهها نیز نیمهرسانا هستند ولی شکاف انرژی بزرگتری دارند. بر این اساس، در حدود یکسوم انواع نانولولههای کربنی رسانا و دو سوم آنها نیمهرسانا هستند.
بر اساس نظريههای فیزیک حالت جامد، الکترونهای ماده مهمترين نقش را در رسانش حرارت مواد جامد بازی میکنند. در مواد جامد ارتعاشات اتمهای تشکیل دهنده نیز در رسانش حرارتی سهیماند اما این تأثیر بسیار ناچیز است. به همین دلیل است که موادی که رسانای الکتریسیتهاند، رسانش حرارتی خوبی نیز دارند و بر عکس. بر این اساس، نانولولههای کربنی رساناهای حرارتی بسیار خوبی نیز به شمار میروند. ساختار یک بعدی نانولولهها موجب ترابرد بالستیک الکترونها در راستای محور نانولوله میشود و جریان الکترونها را در راستای عرضی محدود میکند. به سبب همین ویژگی، نانولولههای کربنی در راستای محور اصلی رسانش حرارتی بسیار خوبی دارند و در راستای عرضی عایق خوبی به شمار میروند. اندازهگیریها نشان میدهد که ضریب هدایت حرارتی نانولولههای تکدیواره در دمای محیط ۳۵۰۰ است؛ در حالی که فلز مس که یک رسانای حرارتی بسیار خوب شناخته میشود، ضریب هدایت حرارتی ۳۸۵ دارد. خوب است بدانید که ضریب هدایت حرارتی عرضی یک نانولولۀ تکدیواره ۱/۵۲ است که تقریباً با ضریب هدایت حرارتی خاک برابری میکند.
نانولولههای کربنی در نگاه اول کاملاً تیره و سیاه رنگ به نظر میرسند؛ از اینرو، شاید خاصیت نوری چندانی برای آنها متصور نباشید. با وجود این، نانولولههای کربنی خاصیت جذب نور و نورتابی خوبی از خود نشان میدهند. ساختار یکبعدی در کنار قطر کم نانولولهها، امکان انباشت الکترونها با چگالی بسیار زیاد در نوک نانولولهها را در صورت اعمال جریان الکتریکی به آنها فراهم میکند. انباشت الکترونی در نوک نانولولهها گسیل نوری توسط آنها را امکانپذیر میسازد. بر اساس چنین خواصی، دیودهای گسیل نور (LED) و آشکارسازهای نوری برپایۀ نانولولههای کربنی تکدیواره ساخته شدهاند. مهمترين مشخصۀ این ادوات نوری که با استفاده از نانولولههای کربنی ساخته شدهاند، قابلیت انتخاب طول موج نور گسیل شده یا آشکار شده توسط نانولولههاست.
روشهای معمول سنتز نانولولههای کربنی مبتنی بر اصول مشترکاند و صرفاً در نحوۀ فراهم کردن شرایط مورد نیاز برای شکلگیری نانولولههای کربنی تفاوت دارند. فرایند کلی شکلگیری نانولولههای کربنی که درمیان همة روشهای متداول سنتز مشترک است، مبتنی بر حل شدن و اشباع اتمهای کربن در یک فلز در دمای بالا و در نهایت، رسوب نانولولههای کربنی از محلول فلز - کربن است که بهصورت نانولولۀکربنی بر سطح فلز رشد میکند؛ این فلز نقش کاتالیست را در رشد نانولولهها بازی میکند و ثابت شده است که در نبود کاتالیست، رشد نانولولهها بسیار ناچیز است. دمای زیاد مورد نیاز برای عملی شدن این فرایند موجب آن میشود که حداقل بخشی از مراحل سنتز در فاز گاز صورت گیرد. تخلية قوس الکتریکی، کند و سوز لیزری و روش رسوب بخار شیمیایی سه روش متداول برای سنتز نانولولههای کربنی هستند.
خواص مختلف و منحصر بهفرد نانولولههای کربنی، کاربردهای بسیار متنوعی را برای آنها فراهم آورده است که بسیاری اجرایی شدهاند. یکی از متداولترین کاربردهای صنعتی و تجاری نانولولههای کربنی، که مرهون خواص مکانیکی عالی آنهاست، استفاده از نانولولهها در ساخت انواع مواد مرکب است. در حال حاضر، از نانولولههای کربنی در مواد مرکب عمدتاً برای افزایش استحکام و کاهش وزن استفاده میشود. این مواد مرکب در صنایع مختلف مانند صنعت تولید تجهیزات ورزشی، صنایع قایقسازی، ساخت توربینهای بادی و تقویت و سبکسازی بدنۀ هواپیما کاربرد جدی دارند. همچنين، مطالعات بسیاری در زمینۀ ساخت مواد مرکب پایۀ بسپار با خاصیت رسانایی حرارتی و الکتریکی با استفاده از نانولولههای کربنی، صورت گرفته است. یکی دیگر از کاربردهای جالب توجه نانولولهها، که از خواص مکانیکی آنها ناشی میشود، استفاده از نانولولههای کربنی برای تقویت بتن است. چنین بتنی در قیاس با بتنهای معمولی استحکام چند هزار برابری از خود نشان میدهد.
۴-۱- فولرنها
فولرنها اولین نانوساختارهای کربنی هستند که در سال ۱۹۵۴ به طور اتفاقی مشاهده شدند. این نانوساختارهای صفر بعدی بهشکل کره و یا بیضی توخالی هستند. اولین نمونه از این دگرشکل کربن به افتخار ریچارد باکمینستر فولر "فولرن باکمینستر" نامیده شد. امروزه نیز به دلیل شباهت ساختاری C60 به توپ فوتبال، آن را باکیبال نیز نامیدهاند. تعداد ۶۰ اتم کربن با ایجاد ۱۲ پنج ضلعی و ۲۰ شش ضلعی، یک باکیبال را تشکیل میدهند (شکل ۸). تعداد پنج و شش ضلعیها در C60 و توپ فوتبال برابر است و چیدمان یکسانی هم دارند. امروزه انواع متنوعی از فولرنها شناخته شدهاند که در شکل (۹) ساختار برخی از آنها را میبینید. روابط هندسی نشان داده است که تمامی فولرنها از زوجهایی از اتمهای کربن، که همواره بیش از ۲۰ عددند، تشکیل شدهاند، حتماً ۱۲ پنج ضلعی دارند و تعداد شش ضلعیهای آنها از رابطۀ زیر پیروی میکند:
در رابطۀ فوق Nh برابر تعداد شش ضلعیها و nc برابر تعداد اتمهای کربن موجود در یک فولرین است. بر این اساس، فولرین C70 دارای ۲۵ شش ضلعی است و شکل ظاهری بیضوی دارد.
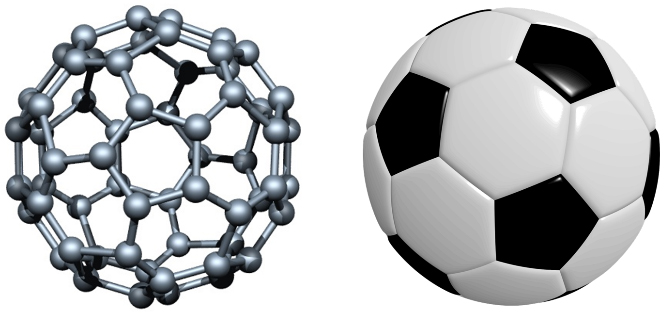
شکل ۸- مقایسۀ توپ فوتبال و باکی بال
با وجود این، گونهای دیگر از فولرنها نیز مشاهده شدهاند که در ساختار خود هفت یا هشتضلعیهای کربنی دارند و میتوانند تعداد بیشتری پنج ضلعی داشته باشند. بر این اساس، فولرنها به دو گروه کلاسیک و غیرکلاسیک دستهبندی میشوند. فولرنهای کلاسیک دارای ساختاری تعریف شده متشکل از ۱۲ پنج ضلعی و تعداد تعریف شدهای شش ضلعیاند؛ در حالی که فولرنهای غیر کلاسیک از این موارد پیروی نمیکنند.
با فاصلة کمی از کشف C60 و افزایش پژوهشها در بارۀ این نانوساختار و روشهای سنتز آن، نانوساختارهای دیگری از کربن به شکل کروی یا بیضوی بسته مشاهده شدند. امروزه این گروه از نانوساختارهای توخالی و بستۀ کربنی به خانوادۀ فولرن موسوماند. در این خانوادۀ نسبتاً بزرگ، کوچکترین عضو ۲۸ اتم کربن (C28) دارد. همچنين، از بزرگترین اعضا میتوان به C720، C960، C1500 و حتی C2160 اشاره کرد که در اصطلاح آنها را فولرنهای غولپیکر مینامند (شکل ۹). برای نشان دادن انواع فولرنها از نماد Cn استفاده میشود که در آن n نشان دهندۀ تعداد اتمهای کربن موجود در ساختار است.
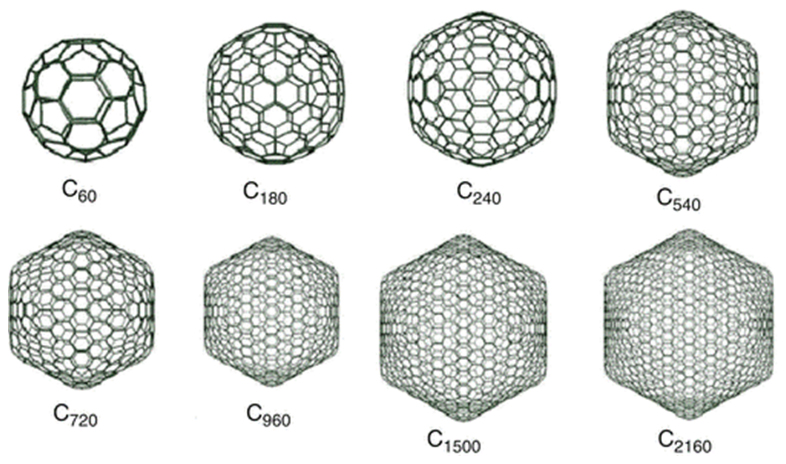
شکل ۹- برخی از فولرنهای بزرگ و غولپیکر
اتمهای کربن قابلیت برقراری پیوندهای مختلف تا ۴ پیوند را دارند و همین موجب آن میشود که شکلگیری انواع ساختارهای حاصل از برقراری پیوندهای چندگانه میان اتمهای کربن امکانپذیر باشد. این امر وجود همپارهای فراوانی از فولرنها را از نظر هندسی ممکن میسازد. برای مثال، محاسبات نشان میدهند که با استفاده از انواع چندضلعیها میتوان با ۱۸۱۲ حالت مختلف، ساختار بستهای از ۶۰ اتم کربن ایجاد کرد؛ با این حال، در میان تمامی این حالتها ساختاری که صرفاً از پنج و شش ضلعیها تشکیل شده باشد و در آن همة ششضلعیها پنجضلعیها را احاطه کردهباشند، پایدارند و چنین ساختاری را با نام C60 میشناسیم. احاطه شدن پنج ضلعیها توسط ششضلعیها را که موجب پایداری ساختاری و شیمیایی فولرن میشود، قانون پنجضلعی جداسازی شده (IPR) مینامند. دومین فولرنی که از این قانون تبعیت میکند، C70 است. ساختار هندسی فولرنهایی با تعداد کربن کمتر از ۶۰ نمیتواند قانون IPR را برآورده کند؛ از اینرو، چنین فولرنهایی ناپایدارند. با بزرگتر شدن فولرن، برآورده کردن شرط IPR برای تعداد بیشتری از همپارها امکانپذیر میشود. با این حال، فولرنهای بزرگتر و کوچکتر بهدلیل وجود پیوندهای ناپایدار میان اتمهای کربنی ناشی از طول و زاوية پیوند غیر تعادلی، ناپایدارند. این امر موجب آن شده است که سنتز و مطالعۀ عملی فولرنهای بزرگتر از C84 مقدور نباشد؛ زیرا جداسازی و بهدست آوردن مقادیر کافی از این فولرنها با خلوص مناسب با دشواریهای بسیاری همراه است. از اینرو، دو فولرن C60 و C70 به دلیل پایداری شیمیایی و ساختاری زیادی که دارند، بیشتر از سایر فولرنها مورد مطالعه و بررسی قرار گرفتهاند. درشکل ۱۰ تعداد همپارهایی که شرط IPR را برآورده میکنند، برای فولرنهای مختلف نشان داده شده است.
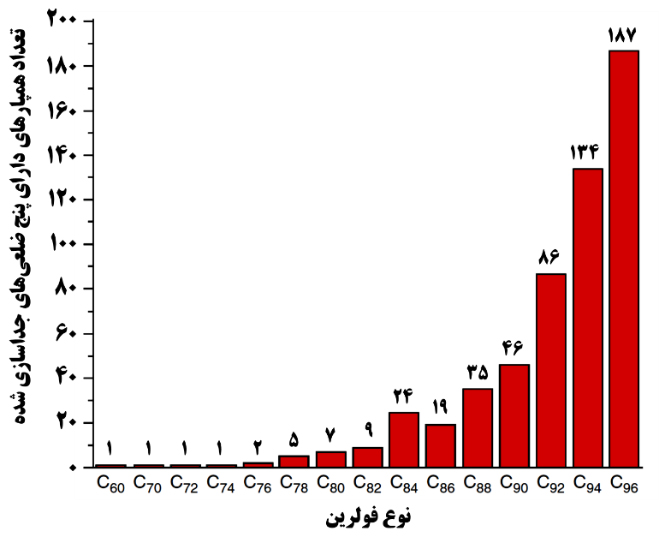
شکل ۱۰- تعداد همپارهای دارای شرط IPR برای فولرنهای مختلف
۱-۴-۱- خواص و کاربرد فولرنها
قطر C60 به عنوان شناختهشدهترین و پایدارترین عضو خانوادۀ فولرنها، حدود ۷ آنگستروم است؛ به همین دلیل، C60 را نانومادهای صفربعدی میدانند و از آن به عنوان درشتترین ذرهای که دوگانگی موج-ذره در آن برقرار است، نام میبرند. ساختار کروی C60 در کنار پیوندهای کووالانسی کربن-کربن موجب ایجاد خواص منحصر به فردی در فولرن شده است.
خواص و ویژگیهای فولرنها از پیوندهای كووالانسي بین اتمهای کربن تشکیلدهندۀ آنها ناشی میشود. در یک ساختار صفحهای (مانند صفحههای گرافیت)، پیوندهای کووالانسی کربن هیبریداسیون sp2 دارند؛ این در حالی است که ساختار منحنی فولرن موجب خمیدگی پیوندها و انحراف آنها از حالت صفحهای میشود که در اصطلاح، «هرمی شدن اتمهای کربن» نام دارد. در نتیجه، هیبریداسیون اتمها از sp2 به sp2.27 تغییر میکند. این امر واکنشپذیری اتمهای کربن و در نتیجه فولرنها را نسبت به ساختارهای صفحهای کربن افزایش میدهد.
مولکولC60 بهصورت برگشتپذیر توانایی کاهش تعداد الکترونها تا شش الکترون را دارد. همچنين، تمایلی به برقراری پیوند شیمیایی از محل حلقههای پنجضلعی خود ندارد. این امر موجب پایداری شیمیایی بالای C60 میشود؛ به طوری که حتی با واکنش شیمیایی و اتصال برخی اتمها یا رادیکالها به سطح آن، همچنان شکل کروی خود را حفظ میکند. از طرفی، وجود اتمهای کربن با پیوندهای غیراشباع در ساختار فولرن این امکان را فراهم میآورد که بتوان با برقراری پیوند شیمیایی، انواع اتمها، رادیکالها و یا مولکولها را به سطح آنها متصل کرد. از این طریق میتوان خواص مهمی مانند حلالیت فولرنها در محیطهای آبی و آلی را کنترل کرد.
فولرنها با انواع حلالها برهمکنش منحصر بهفردی دارند؛ به این ترتیب که ساختار مولکولی آنها سخت است و به همین سبب، بر اثر برهمکنش با حلال دچار هیچ تغییری نمیشوند. بنا بر این، انحلال پذیری فولرنها در انواع حلالها با هیچ یک از نظريههای موجود قابل پیشبینی نیست. فولرنها ذاتاً بهدلیل ساختار حلقوی اتمهای کربن، آبگریزند؛ با وجود این، حلالیت چندان مناسبی در برخی حلالهای آلی نیز ندارند. از اینرو، پخش فولرینها درون این حلالها با تجمعی از آنها همراه خواهد بود. با این حال، برهمکنش میان ساختار حلقوی تشکیلدهندۀ فولرنها و حلالهای آروماتیک مانند تولوئن، موجب افزایش حلالیت فولرن در چنین حلالهایی میشود.
پیوندهای میان اتمهای کربن پایدار و مستحکماند و موجب پایداری ساختاری فولرنها در فشار و دمای بالا میشوند. به همین سبب، C60 به مادهای تبدیل شده است که میتواند مقاومت بسیار زیادی در برابر نیروهای فشاری از خود نشان دهد. فولرنها جذب نوری بسیار قوی در محدودة فرابنفش از خود نشان میدهند که از ساختارهای حلقوی تشکیل دهندۀ آنها ناشی میشود. فولرن C70 نسبت به C60 جذب بیشتری در ناحية مرئی دارد. طیف جذبی C60 در حدود ۴۳۰ نانومتر دارای یک کمینه است که موجب میشود محلولهای رقیق آن به رنگ بنفش درآیند؛ در حالیکه جذب نور C70 در طول موج ۶۵۰ نانومتر تقریباً برابر صفر است و به محلولهای رقیق C70 رنگ قرمز یا نارنجی میدهد.
فولرنهای C60 در محیط غیر حلال و حالت جامد به صورت منظم روی هم انباشته میشوند و شبكة بلوری FCC را تشکیل میدهند. ثابت شبكة چنین ساختاری برابر ۱۴/۲ آنگستروم است. در صورتی که این ساختار بلور فولرنی با اتمهای فلزات قلیایی مانند پتاسیم، سزیم و روبیدیم آلایش شود، ترکیب حاصل در دمای در حدود ۳۳ کلوین از خود خاصیت ابررسانایی نشان میدهد.
این نانومادۀ صفربعدی در صنایع مختلف کاربرد و اهمیت دارد. برخی از متداولترین کاربردهای فولرن عبارتاند از: ساخت نانوحسگر، مواد آنتیاکسیدان، ساخت سلولهای خورشیدی، ذخیرهسازی هیدروژن، ساخت انواع مواد نانوترکیب، دارورسانی هدفمند، جلوگیری از رشد باکتری، تولید روانکنندههای جامد و استفاده به عنوان افزودنی در روانسازهای مایع مانند روغن موتور. در کنار کاربردهای فناورانۀ C60، این نانوماده به دلیل خواص مهمی که دارد، کاربردهای زیستی متنوعی پیدا کرده است. این کاربردها را میتوان در این موارد خلاصه کرد: مهار آنزیمی، کاربردهای ضد ویروسی، برش دادن و شکستن رشتههای DNA، و نورپویادرمانی سرطان. همچنين، این دگرشکل نسبت به نور حساس است و با تغییر طول موج نور، خواص الکتریکی متفاوتی از خود نشان میدهد. خواص الکتریکی جالب توجه فولرنها منجر به کاربرد این نانوماده در پیلهای سوختی، سلولهای خورشیدی، آشکارسازهای نوری اشعه ایکس و... شده است.
۲- نانوساختارهای طلا
شواهد موجود حکایت از آن دارد که انسان از سالهای دور و بدون اطلاع از ماهیت نانوذرات طلا، با این ذرات آشنا بوده و از تغییر رنگ آنها برای ساخت شیشههای رنگی بهره میگرفته است. نمونهای از آشنایی انسان با نانوذرات فلزی طلا و نقره در جامی به نام جام لیکرگوس مشاهده شده است. در قرن چهارم میلادی در روم باستان، جامی ساخته شد که با تاباندن نور از داخل آن به رنگ قرمز مایل به صورتی، و با تاباندن نور از خارج به آن به رنگ سبز مایل به زرد درمیآمد.
با تغییر ابعاد نانوذرات طلا و حتی تغییر شکلشان، رنگهای متفاوتی از خود نشان میدهند. این رنگها در نتیجۀ برهمکنش الکترونهای نوار هدایت فلز با میدانهای الکتریکی نور تشکیل میشوند. به این پدیده در اصطلاح، تشدید پلاسمونهای سطحی موضعی میگویند. این برهمکنش با تغییر اندازه و شکل نانوذرات دستخوش تغییر میشود؛ برای مثال، نانوذرات کروی طلا در مقایسه با نانوذرات هرمیشکل هماندازه، یا نانوذرات کروی در مقایسه با نانوذرات کروی غیرهماندازه رنگهای متفاوتی دارند. درنتیجه، رنگهای متفاوتی از نانوذرات با ابعاد و اشکال مختلف را مشاهده میکنیم. این ویژگی نهتنها در مورد نانوساختارهای طلا بلکه در مورد نانوساختارهای سایر عناصر نیز صادق است. در شکل ۱۱ تغییر رنگ نانوذرات کروی طلا را با افزایش اندازۀ آنها از ۳ تا ۱۰۰ نانومتر (از چپ به راست) مشاهده میکنید.

شکل ۱۱- تغییر رنگ نانوذرات کروی طلا با اندازههای مختلف پخش شده درون آب
اشاره شد که طلا فلزی نجیب است؛ بدین معنا که در برابر اکسیداسیون و واکنشهای شیمیایی از خود مقاومت نشان میدهد اما این موضوع در مورد نانوذرات آن صادق نیست. نانوذرات طلا در دماهای پایین (دمای اتاق) فعالیت کاتالیستی شگفتآوری از خود نشان میدهند و به گزینۀ مناسبی برای استفاده به عنوان کاتالیست در برخی واکنشهای شیمیایی تبدیل میشوند.
از نظر رسانایی الکتریکی، طلا کیفیت خوبی دارد و از هدایت الکتریکی بالایی برخوردار است. اما این پدیده نیز در مقیاس نانو تغییر میکند. طلایی که میتوانست جزء اولین انتخابها برای کاربردهای الکترونیکی باشد، در مقیاس نانو، بسته به اندازه و شکل نانوذرات، ممکن است خواص نیمههادی پیدا کند یا مقاومت الکتریکیاش افزایش یابد.
نقطة ذوب طلای خالص، ۱۰۶۴ درجه سانتیگراد است. همان طور که پیشتر گفته شده است، با تغییر ابعاد نانوذرات، نقطة ذوب آنها نیز دستخوش تغییر میشود؛ به طوری که با کاهش ابعاد نانوذرات، نقطة ذوب نیز کاهش مییابد. برای مثال، نانوذرات ۳۰ نانومتر طلا نسبت به حالت تودهای آن نقطة ذوب بسیار پایینتری از دارند و به همین ترتیب، نقطة ذوب نانوذرات ۳ نانومتر طلا در مقایسه با نانوذرات ۳۰ نانومتر بهشدت افت میکند. علت این پدیده، همان افزایش نسبت اتمهای سطحی به اتمهای داخلی ذره میباشد. اتمهای سطحی عدد همسایگی کمتری دارند؛ این موضوع باعث میشود که اتمها چسبندگی کمتری به هم داشته باشند و راحتتر از حالت جامد به حالت مایع تغییر فاز دهند.
نانوذرات طلا به دلیل خواص جالب توجهی که دارند، در زمینههای مختلفی مورد مطالعه و استفاده قرار گرفتهاند. یکی از این زمینهها فرایندهای دارورسانی و تشخیص و تصویربرداری پزشکی است. استفاده از نانوذرات طلا به عنوان کاتالیست فرایند خالصسازی هیدروژن برای مصرف پیل سوختی یکی دیگر از کاربردهای مهمی است که در سالهای اخیر مورد توجه قرار گرفته است. این نانوذرات میتوانند کربن منوکسید را به کربن دیاکسید تبدیل کنند؛ بدون آنکه هیدروژنی مصرف شود. این فرایند موجب میشود تا فرایندی کارآمد و ارزان قیمت برای خالصسازی هیدروژن برای مصرف پیل سوختی ارائه گردد.
پایداری شیمیایی بسیار زیاد طلا موجب آن میشود كه پیشمادههای فراوانی از طلا برای استفاده در سنتز شیمیایی وجود نداشته باشد. سه ترکیب کلرو اوریک اسید (HAuCl4·nH2O)، نیترات طلا (AuH(NO3)4.xH2O) و استات طلا (Au(O2CCH3)3) از معروفترین پیشمادههایی هستند که برای سنتز انواع نانوذرات طلا مورد استفاده قرار میگیرند. کاهش شیمیایی در محیطهای آبی یا آلی متداولترین روش سنتز نانوذرات طلا در شکلهای مختلف است. یونهای موجود در این دو ترکیب شیمیایی بهراحتی کاهش مييابند و به طلای عنصری تبدیل میشوند؛ از اینرو، برای تولید طلا به کاهندههای بسیار قوی نیازي نيست. از انواع کاهندههای ملایم، مانند سیتریک اسید (C6H8O7) یا آسکوربیک اسید (C6H8O6) تا کاهندههای قوی مانند سدیم بوروهیدرید (NaBH4)، برای سنتز نانوذرات در محیطهای محلول استفاده شده است.
۳-نانوساختارهای نقره
۱-۳- ویژگیها و خواص نانوذرات نقره
اولین آشنایی بشر با فلز گرانبهایی به نام نقره به هزاران سال پیش برمیگردد. نقره فلزی چکشخوار و انعطافپذیر است؛ با این حال آنچه این فلز را از سایر فلزات متمایز میکند، رسانایی الکتریکی و حرارتی فوقالعادة آن است. در کنار این موارد، پایداری زياد شیمیایی و مقاومت بالا در برابر ترکیب شدن با عوامل محیطی و خوردگی، نقره را به فلزی مقاوم تبدیل کرده است. این امر موجب وسعت دامنة کاربرد نقره میشود. یکی از مشخصههای جالب توجه نقره، خاصیت ضدباکتری آن است. بر اساس اسناد تاریخی، نقره را میتوان اولین مادهای دانست که انسان با خاصیت ضدباکتری آن آشنا شده است. امروزه نیز از خاصیت ضدمیکروبی نقره در زمینههایی چون پزشکی و دندانپزشکی استفاده میشود.
کاهش ابعاد نانوذرات نقره نیز موجب تغییر خواص این عنصر میشود. در این میان، اولین مشخصة مهم تغییر رنگ نانوذرات نقره با تغییر اندازه و نیز تغییر شکل آنهاست (شکل ۱۲). نانوذرات نقره همانند نانوذرات طلا به دلیل تشدید پلاسمونهای سطحی موضعی تغییر رنگ میدهند. با وجود این، قابلیت ایجاد طیف بسیار وسیعی از رنگها را دارند که با تغییر اندازه، شکل هندسی و نسبت ابعادی نانوذرات تغییر میکند. در کنار تغییر رنگ نانوذرات نقره و وابستگی رنگ آنها به اندازهشان، نقطة ذوب این نانوذرات نیز مانند همة نانوذرات فلزی با کاهش اندازه کاهش مییابد.

شکل ۱۲- تغییر رنگ نانوذرات کروی نقره با تغییر اندازه آنها
فعالیت شیمیایی بالا یکی دیگر از مشخصههای نانوذرات نقره است که از کاهش ابعاد آنها ناشی میشود. با وجود این، خاصیت ضدباکتری فوقالعادة اين نانوذرات را میتوان شناخته شدهترین ويژگي آنها دانست. همان طور که پیشتر گفته شد، فلز نقره ذاتاً خاصیت ضدباکتری دارد؛ با اینحال، کاهش اندازه و افزایش چشمگیر سطح ویژۀ نانوذرات نقره موجب بیشترین برهمکنش شیمیایی ممکن میان نقره و محیط پیرامون میشود. حاصل چنین برهمکنش شدت یافتهای افزایش چندین برابری خاصیت ضدباکتری در نانوذرات نقره است.
همان طور که پیش از این گفته شد، در میان انواع کاربردهای موجود و پیش بینی شده برای انواع نانوذرات نقره، کاربردهای ضدباکتری این نانوذرات بیشتر شناخته شده است. به همین سبب، امروزه از نانوذرات نقره در انواع تجهیزات پزشکی نوین برای ایجاد سطحی عاری از باکتری و میکروب استفاده میکنند. مطالعات نشان میدهند که این نانوذرات خاصیت ضدویروسی نیز دارند؛ به طوری که طبق گزارشها، تأثير ضدویروسی آنها بر ویروس ایدز نوع اول چندین برابر بیشتر از طلا بودهاست و باعث از بین رفتن آن شدهاند. در گزارشهای دیگر، اثر نانوذرات نقره بر ساير ویروسها مانند هپاتیت B بررسی شده است. بر این اساس، میتوان نتیجه گرفت كه نانونقره با کنترل سرعت رشد عوامل بیماریزا میتواند نقش بسزایی در توفيق پزشکی نوین و درمان بیماریهای سخت و درمانناپذیر داشته باشد.
نقره از دیرباز در صنایع شیمیایی کاربردهای گستردهای به ویژه به عنوان کاتالیست داشته است. امروزه استفاده از نانوذرات نقره به عنوان کاتالیست بهدلیل سطح ویژه و فعالیت شیمیایی بالا جذابیت بسیاری دارد؛ بهویژه اينكه استفاده از نانوذرات نقره موجب کاهش مصرف این فلز گرانبها در کنار افزایش کارایی کاتالیست میشود. نانوذرات نقره به عنوان کاتالیست در فرایندهای اکسیداسیون ترکیبهای آلایندة آلی کاربرد دارند. همچنين، به عنوان بهبود دهنده به انواع فتوکاتالیستها افزوده ميشوند و کارایی آنها را افزایش میدهند.
البته همان طور که گفته شد، کاربردهای نانوساختارهای نقره شامل موارد متنوعی است. از این نانوساختارها در ادوات نوری و الکترونیکی، بستهبندی مواد غذایی، ساخت جوهرهای رسانا و ساخت نانوحسگر نیز استفاده میشود. نمونههایی از این کاربردها را در شکل ۱۳ مشاهده ميكنيد.
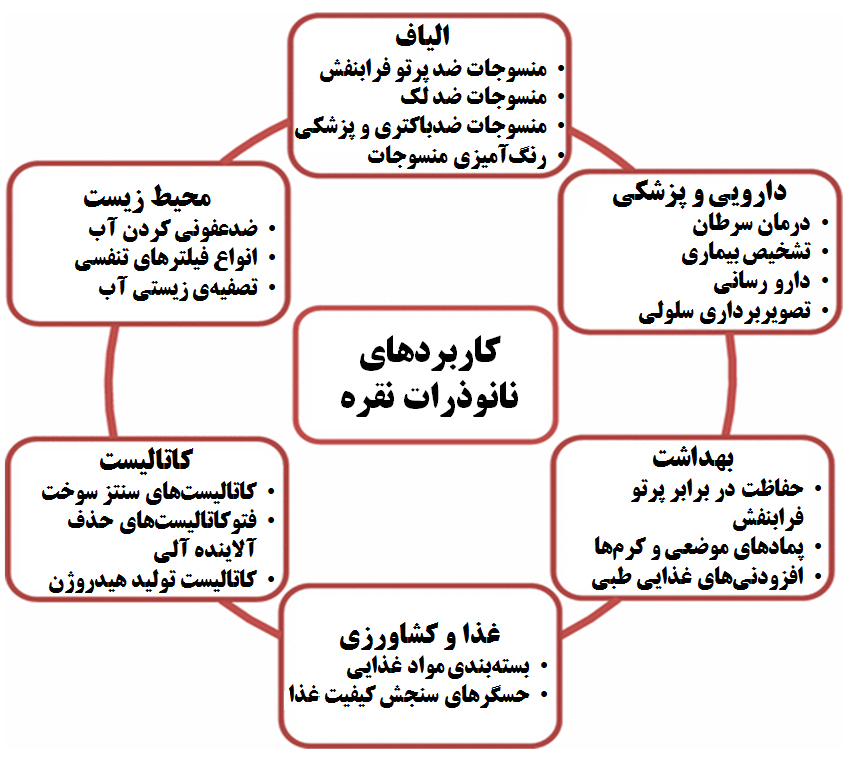
شکل ۱۳- کاربرهای نانوذرات نقره در حوزههای مختلف
۲-۳- روشهای سنتز نانوذرات نقره
در سالهای اخیر روشهای متنوعی برای سنتز انواع نانوذرات فلزی ارائه شده است که برای سنتز نانوذرات نقره نیز کاربرد دارند. این روشها را میتوان در دو گروه بالا به پایین و پایین بهبالا تقسیم کرد. هرکدام از این روشها، مزایا و معایب خود را دارند. از زاويهاي دیگر، روشهای سنتز نانوذرات نقره را میتوان به سه گروه کلی فیزیکی، شيمیایی و زیستی تقسیم کرد.
روشهای فیزیکی: روشهای فیزیکی سنتز نانوذرات شامل فرایندهایی است که بدون واکنش شیمیایی و صرفاً بر اثر برخی پدیدههای فیزیکی نانوذرات صورت ميگيرند. اکثر روشهای فیزیکی را میتوان در مجموعة روشهای بالا به پایین دستهبندی کرد. روشهایی مانند کند و سوز لیزری و انفجار الکتریکی سیم از جمله روشهای فیزیکی هستند که برای سنتز نانوذرات نقره از یک قطعۀ تودهای نقره مورد استفاده قرار گرفتهاند.
کاهش شیمیایی: امروزه نانوذرات نقره در شکلهای مختلف برای کاربردهای گوناگون سنتز میشوند. در میان روشهای مورد استفاده، انواع روشهای شیمیایی پرکاربردترین و کارآمدترین روشها برای سنتز این نانوذرات با توزیع اندازة باریک، شکل و ریزساختار کنترل شده هستند. تمامی این روشهای شیمیایی که جزء روشهای شیمی تَر محسوب میشوند، یک وجه اشتراک دارند: کاهش شیمیایی یونهای نقره. در روشهای مبتنی بر کاهش شیمیایی، یک پیشماده حاوی یونهای نقره (مانند انواع نمکهای حاوی نقره از جمله نقره نیترات (AgNO3)، نقره استات (AgC2H3O2)، نقره کلرید (AgCl) و نقره سولفات (Ag2SO4)) در محیط محلول توسط یک عامل کاهندة قوی مانند سدیم بورهیدرید (NaBH4) یا کاهندههای ملایم مانند آسکوربیک اسید (C6H8O6) کاهیده ميشود و نانوذرات نقره حاصل میآيد.
سنتز هیدروترمال: یکی دیگر از روشهای سنتز نانوذرات نقره روش هیدروترمال است. این روش دستيابي به ذراتی با خلوص بسیار بالا و ساختار بلوری را ممکن میسازد. از مهمترين مزیتهای این روش، دستيابي به توزیع اندازۀ باریک و ذرات تکبلور و نيز کاهش مقدار مواد آلاینده و پسماند حاصل از سنتز است. با وجود این، روش هيدروترمال تشابه بسیاری با روش کاهش شیمیایی دارد و تنها تفاوت آن با روش ياد شده، انجام گرفتن فرایند در محفظة بسته و تحت فشار و دمای بالاست. چنین فرایندی سنتز نانوساختارهای خاصی از نقره را امکانپذير ميسازد که با روش کاهش شيمیایی در شرایط عادی مقدور نیست.
روشهای سنتز زیستی: به گروهی از روشهای شیمیایی در محیطهای آبی که در آنها برای کاهش یونهای نقره و پایدارسازی ذرات در حال رشد از انواع مولکولهای زیستی استفاده میشود، در اصطلاح روشهای زیستی میگویند. با وجود این، اصول حاکم در این روشها مشابه همان چیزی است که در سنتز شیمیایی عادی برقرار است. یکی دیگر از روشهای سنتز زیستی، استفاده از موجودات زندهای مانند باکتریها و قارچهای تک سلولی برای تولید نانوذرات نقره است. در این روشها، موجود زنده طی سوخت و سازی که انجام میدهد، یونهای نقره را به نقرة فلزی تبدیل و ذخیره میکند. اتمهای نقره بهتدریج در کنار هم انباشت و به ذرات نقره تبدیل میشوند؛ این انباشت ممکن است درون سلول یا بیرون از آن صورت گیرد. با کنترل محیط کشت باکتری و زمان آغاز به فعالیت باکتریها میتوان اندازۀ ذرات شکل گرفته درون بدن باکتریها را کنترل كرد و نانوذرات دلخواه را بهدست آورد.
۴- نانوساختارهای اکسید تیتانیوم
تیتانیوم (Ti) نهمین عنصر فراوان در پوستة زمین است. اکسید این فلز (TiO2)، که به تیتانیا معروف است، مادۀ جامد غیرآلی و سفیدرنگی است که در برابر حرارت پایدار (دمای ذوب حدود ۱۸۵۴ درجه سانتیگراد)، غیرقابل اشتعال، انحلالناپذیر در آب و حلالهای آلی، بیخطر و زیستسازگار است. تیتانیوم دیاکسید در شرایط عادی با سه ساختار آناتاز، روتایل و بروکیت متبلور میشود. ساختار بلوری آناتاز و روتایل، مکعبی و ساختار بروکیت، اورتورمبیک است. شکل ۱۵ سلول واحد این سه ساختار بلوری را نشان میدهد. هر سه اکسید تیاتینوم نیمهرسانا هستند و بهترتیب دارای شکاف انرژی به بزرگی ۳/۲، ۳/۰۲ و ۲/۹۶ الکترونولت برای آناتاز، روتایل و بروکیت هستند؛ این امر موجب میشود که تیتانیا اهمیت بسیار زیادی در انواع کاربردهای فناورانه پیدا کند. از میان این سه ساختار، آناتاز و روتایل از خود خاصیت فتوکاتالیستی نشان میدهند. ساختار روتایل پایدارترین فاز تیتانیوم دیاکسید در دمای بیشتر از ۸۰۰ سانتیگراد است؛ در حالی که در محدودة دمایی ۸۰۰-۶۵۰ سانتیگراد مخلوطی از دوفاز روتایل و آناتاز وجود دارد و در دمای ۶۵۰-۴۵۰ سانتیگراد فاز آناتاز پایدار است؛ از این رو، با حرارت دادن یک نمونة اولیة تیتانیوم دیاکسید که ساختار بلوری آن به خوبی شکل نگرفته است، در آغاز و در حدود دمای ۴۵۰سانتیگراد ساختار غالب، آناتاز خواهد بود و با افزایش دما بهتدريج ساختار روتایل نمایان خواهد شد. در نهایت، با رسیدن به دمای ۸۰۰ سانتیگراد کل ساختار روتایل خواهد بود.
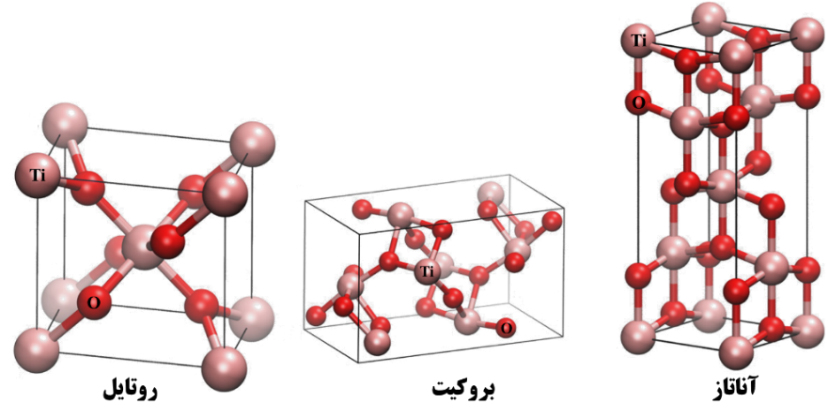
شکل ۱۴- نمایی از ساختمان بلوری سه ساختار متداول تیتانیوم دیاکسید
تیتانیوم دیاکسید بهدلیل خواص جالبی که دارد، در زمینههای مختلف کاربردهای فراوانی پیدا کرده است. به طوري که در ساخت بسیاری از موادی که در زندگی ما اهميت دارند، از تیتانیا استفاده شده است. برای مثال، تیتانیا یکی از مهمترين رنگدانههای صنعتی است؛ به طوری که امروزه اکثر سطوح سفیدرنگ حاوی TiO2 میباشند. این ماده از دیرباز در بسیاری از محصولات صنعتی، از جمله رنگها، پوششها، چسبها، کاغذ و مقوا، پلاستیک و لاستیک، جوهرهای چاپ، منسوجات، کاتالیستها، سرامیکها، عوامل تصفية آب و رنگهای خوراکی مورد استفاده بودهاست. از دیگر کاربردهای تیتانیا میتوان به استفاده در ساخت انواع شیشههای مورد استفاده در ساخت عدسیها بهدلیل ضریب شکست بالا (۲/۷۶-۲/۵۲)، استفاده به عنوان پرکننده در صنایع لاستیکسازی، تولید کاغذ، سرامیک و مواد آرایشی و دارویی، استفاده به عنوان پوشش روی سطوح مصنوعات فلزی، بهخصوص بدنۀ فضاپیماها بهدلیل استحکام و مقاومت به خوردگی بالا، استفاده به عنوان روکش الکترودهای جوشکاری و دیالکتریک در خازنها بهجهت داشتن ثابت دیالکتریک بالا (۱۷۳-۸۶) و ... اشاره کرد. گسترة وسیع کاربردهای تیتانیا نشاندهندۀ اهمیت بسیار زیاد این ماده است.
بزرگی شکاف انرژی دو ساختار نیمهرسانای تیتانیا، آناتاز و روتایل به قدري است که میتواند پرتوهای فرابنفش نزدیک ( ۴/۱۳eV-۳/۱۰eV ) را که توسط لایه اوزون جذب نمیشوند و به سطح زمین میرسند، جذب کند. این ویژگی موجب شدهاست كه از تیتانیوم دیاکسید در بسیاری ازمواردي استفاده شود که به جذب یا حذف پرتو فرابنفش نیاز است. در این زمینه یکی از کاربردهای متداول، استفاده از تیتانیا برای ساخت لایۀ جاذب فرابنفش در عینکهای آفتابی و شیشههای ساختمانهاست.
خواص نیمهرسانایی تیتانیا با تغییر محیط پیرامون آن دستخوش تغییر میشود. یکی از بارزترین نمونههای چنین تغییری افزایش و کاهش هدایت الکتریکی TiO2 با تغییر مقدار اکسیژن در محیط اطراف تیتانیا است؛ به این ترتیب که با کاهش فشار جزئی اکسیژن، هدایت الکتریکی TiO2 افزایش مییابد و بر عکس. برای مثال، به ازای کاهش فشار اکسیژن از ۱ به ۰/۱ اتمسفر، هدایت الکتریکی تیتانیا تا ۱۰ برابر افزایش مییابد. چنین رفتاری تیتانیوم دیاکسید را به مادهای مناسب برای ساخت انواع حسگرهای اکسیژن تبدیل کرده است.
امروزه با تولید تجاری نانوذرات تیتانیوم دیاکسید، کاربردهای این ماده گسترش بیشتری يافته و کارایی محصولات تولید شده با آن بهبود چشمگیری پیدا کرده است. در بسیاری از کاربردهای اشاره شده برای تیتانیا، خواصی مانند اندازة ذرات، نسبت سطح به حجم و سطح ویژه و شکل هندسی ذرات خواصی تعیینکنندهاند که با کاهش اندازة ذرات بهبود مییابند؛ از اینرو، استفاده از نانوذرات تیتانیا موجب بهبود کارایی این محصولات ميشود و کیفیت آنها را به میزان قابل توجهی افزایش میدهد. امکان اصلاح خواص نانوذرات تیتانیا از فرصتهایی است که فناوری نانو پیش روی محصولات مبتنی بر تیتانیوم دیاکسید گذاشته است.
۱-۴- خاصیت فتوکاتالیستی نانوذرات تیتانیوم دیاکسید
با کاهش اندازۀ ذرات تیتانیوم دیاکسید و نانومقیاس شدن آنها، امکان اصلاح بسیاری از خواص نانوذرات تیتانیا فراهم میشود. مهمترين خاصیت نانوذرات تیتانیا که در ابعاد نانو بسیار مورد توجه قرار گرفته، خاصیت فتوکاتالیستی آنهاست. فتوکاتالیستها موادی هستند که در صورت تابش نور به آنها فعالیت کاتالیستی از خود نشان میدهند. امروزه اقدامات فراوانی برای استفاده از خاصیت فتوکاتالیستی نانوذرات تیتانیا در زمینههای مختلف از جمله ساخت انواع سطوح خودتمیزشونده، ساخت سطوح ضدباکتری، تصفیة میکروبی و شیمیایی هوا و تصفیة میکروبی و شیمیایی آب صورت گرفته است.
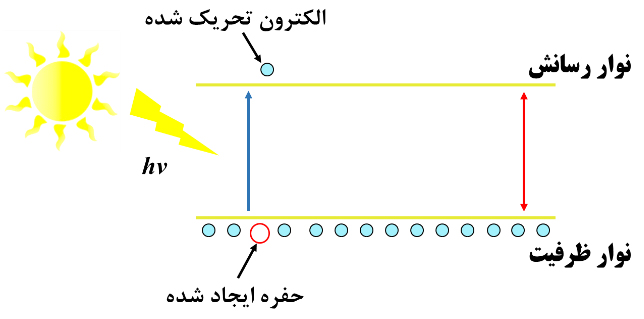
شکل ۱۵- تحریک الکترونها توسط فوتونهای پر انرژی و تولید الکترون و حفره در یک نيمهرسانا.
فرایند فتوکاتالیستی در اثر جذب انرژی یک فوتون و برانگیخته شدن اتمها صورت میگیرد. با تابش فوتونهایی با انرژی بیش از بزرگی شکاف انرژی (Eg) نیمهرسانا، الکترونهای نوار ظرفیت برانگیخته و به نوار رسانش منتقل ميشوند و در نوار رسانش حفرههایی با بار مثبت بهجا میگذارند (شکل ۱۵). از این الکترون و حفرة ایجاد شده استفادههای متنوعی میتوان کرد. میدانیم که واکنشهای شیمیایی حاصل تبادل الکترون میان گونههای مختلف درگیر واکنش هستند. بر این اساس هر اقدامی که بتواند تبادل این الکترونها را آسان سازد، میتواند واکنش شیمیایی را تسهیل کند. در فرایندهای فتوکاتالیستی این الکترونها و حفرههای ایجاد شده در اثر برانگیزش نوری، برای تسهیل واکنش شیمیایی بهکارميروند.
حالت برانگیخته حالتی ناپایدار است و مادۀ برانگیخته شده تمایل بسیار زيادي به دفع انرژی و بازگشت به حالت پایه دارد. بر این اساس، در بسیاری از مواد نیمهرسانا الکترونِ برانگیخته شده که به نوار رسانش انتقال یافته است، به سرعت و با گسیل انرژی به نوار ظرفیت برميگردد و با حفرة موجود در این نوار بازترکیب میشود. در بسیاری از مواد نیمهرسانا، فرایند بازترکیب شدن با سرعت بسیار زيادي رخ میدهد؛ به نحوی که امکان بهرهگیری از زوج الکترون–حفره ایجاد شده برای فرایندهایی که نسبتاً کندتر رخ میدهند، از جمله واکنش شیمیایی، وجود ندارد. مهمترين مزیت تیاتنیوم دیاکسید به سایر مواد نیمهرسانا شاید این باشد که سرعت بازترکیب زوجهای الکترون–حفره در این ترکیب شیمیایی آن قدر کم است كه نميتوان از آنها برای پیشبرد واکنش شیمیایی استفاده کرد.
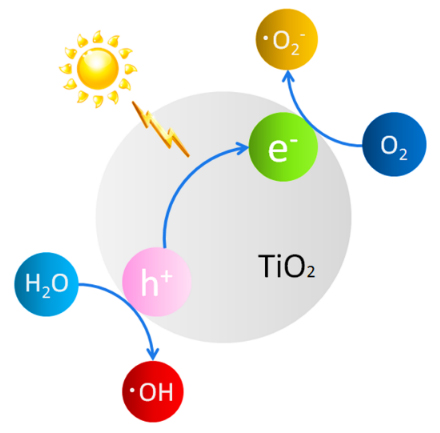
شکل ۱۶- تولید آنیون سوپر اکسید و رادیکال هیدروکسی توسط زوج الکترون–حفرة تولید شده در تیتانیوم دیاکسید برانگیخته
در واکنشهای فتوکاتالیستی، با جذب فوتونهای پرانرژی، زوجهای الکترون–حفره تولید شده در سطح با گونههای شیمیایی جذب شده روی سطح برهمکنش دارند و آنها را کاهش ميدهند یا اکسید میکنند. مهمترين مثال از این واکنشها تبدیل مولکولهای آب جذب شده بر سطح تیتانیا به رادیکالهای فعال هیدروکسی (OH•) و تبدیل مولکولهای اکسیژن جذب شده روی سطح به آنیونهای سوپراکسید است (شکل ۱۶). این گونههای بسیار فعال شیمیایی توانایی بسیار زيادي در اکسید کردن یا کاهیدن انواع مواد شیمیایی دارند. آنها با حمله به انواع ترکیبات آلی موجود در محیط، اين تركيبات را به ترکیبهای بیضرری برای محیط زیست مانند کربن دیاکسید و آب تبدیل میکنند. از اینرو، از اين گونهها برای از بین بردن انواع آلایندههای آلی موجود در آب یا هوا میتوان بهره گرفت. همچنين، این گونهها میتوانند موجب مرگ انواع باکتریها شوند و به ضدعفونی کردن محیط کمک کنند. این امر موجب آن شده است كه از تیتانیوم دیاکسید به عنوان یک فتوکاتالیست نویدبخش برای حذف انواع آلودگیها در آب و هوا استفاده شود.
نکتۀ حائز اهمیت در مورد استفاده از تیتانیوم دیاکسید به عنوان فتوکاتالیست این است که با وجود اینکه ساختار روتایل دارای شکاف انرژی در نزدیکی محدودة نور مرئی است ( ۳/۰۲eV) و انتظار میرود فعالیت فتوکاتالیستی زيادي داشته باشد، به دلیل سرعت زياد بازترکیب الکترون-حفره در این ساختار، فعالیت فتوکاتالیستی قابل توجهی ندارد. این در حالی است که ساختار آناتاز دارای سرعت مناسب بازترکیب الکترون-حفره است و میتواند با رساندن این زوج به گونههای جذب شده روی سطح، موجب واکنشهای فتوکاتالیستی شود. با اینحال، شکاف انرژی ساختار آناتاز ۳/۲eV است و در محدودة فرابنفش قرار دارد؛ از اینرو، تیتانیوم دیاکسید معمولی صرفاً در صورت تابش نور فرابنفش از خود، فعالیت فتوکاتالیستی نشان میدهد. این امر که فعالیت فتوکاتالیستی تیتانیای خالص را در اثر تابش نور مرئی بسیار محدود میکند، سد بزرگی در مسیر توسعۀ محصولات مبتنی بر خاصیت فتوکاتالیستی تیتانیا به شمار میرود.
با پیشرفتهای صورت گرفته در فناوری نانو و امکان دستکاری ساختار و خواص مواد با این فناوری، امروزه دستاوردهاي قابل توجهی در زمینه اصلاح ساختار تیتانیا با هدف کاهش شکاف انرژی و فعال کردن آن در محدودة نور مرئی حاصل آمده است. آلایش ساختار تیتانیا با برخی اتمها از جمله ید، نقره، و منگنز از اقدامات بسیار مؤثر برای رسيدن به این هدف بوده است. این اتمها با ایجاد ترازهای جدید بین نوار رسانش و ظرفیت، شکاف انرژی تیتانیا را بهمقدار مناسبی کاهش میدهند تا در محدوده نور مرئی نیز فعال گردد.
از دیگر اقدامات صورت گرفته برای بهبود کارایی فتوکاتالیستی تیتانیا، سنتز انواع نانوترکیبهای تیتانیا با سایر نانوساختارها از جمله نانولولههای کربنی، گرافن، انواع نانوذرات فلزی، نانوذرات نیمهرسانا با شکاف انرژی کوچکتر و برخی ترکیبهای آلی است که موجب بهبود جذب نور مرئی، افزایش الکترون - حفرة تولید شده و کاهش نرخ بازترکیب آنها میشود.
یکی دیگر از عوامل ساختاری تأثیرگذار در خواص فتوکاتالیستی تیتانیا، اندازۀ اين ذرات است؛ به این ترتیب که کاهش اندازۀ ذره موجب بهبود فعالیت فتوکاتالیستی تیتانیا از چند طریق میشود. از جمله، با کاهش اندازۀ ذره، نفوذ زوج الکترون-حفره به سطح تسهيل مي شود و احتمال تماس و واکنش با گونههای شیمیایی جذب شده روی سطح افزایش میيابد. از طرفی، با کاهش اندازه در مقیاس نانو، ترازهای انرژی به دلیل تغییر اندازه دستخوش تغییر شده و در نتيجه گسسته میشوند. این امر موجب آن میشود كه با کاهش اندازه، ترازهای جدیدی برای ایجاد زوج الکترون-حفره به وجود آيند. البته گفتني است که این کاهش اندازه مادامی بر فعالیت فتوکاتالیستی تأثیر مثبت دارد که موجب ایجاد ترازهای جدید با شکاف انرژی در محدودة نور مرئی شود؛ از اینرو، کاهش بیش از حد اندازۀ ذرات اثر عکس خواهد داشت.
۲-۴- روشهای سنتز نانوذرات تیتانیوم دیاکسید
کاربردهای متنوع تیتانیوم دیاکسید ضرورت استفاده از روشهای مختلف جهت دستيابي به ساختارهای مناسب برای این کاربردها را برجسته میکند. تاکنون روشهای متعددی برای سنتز نانوذرات TiO2 مورد استفاده قرار گرفته است كه هر یک مزایا و معایب خود را دارند و به محصولاتی با گسترة وسیعی از ویژگیها و در نتیجه کاربردها منتهی میشوند. سل-ژل، هیدروترمال، تجزیة حرارتی پاشش شعله و رسوب بخار شیمیایی چهار روش متداول برای تولید نانوذرات اکسید تیتانیم هستند.

