Blog
مکانیسم چرخه ی سلولی
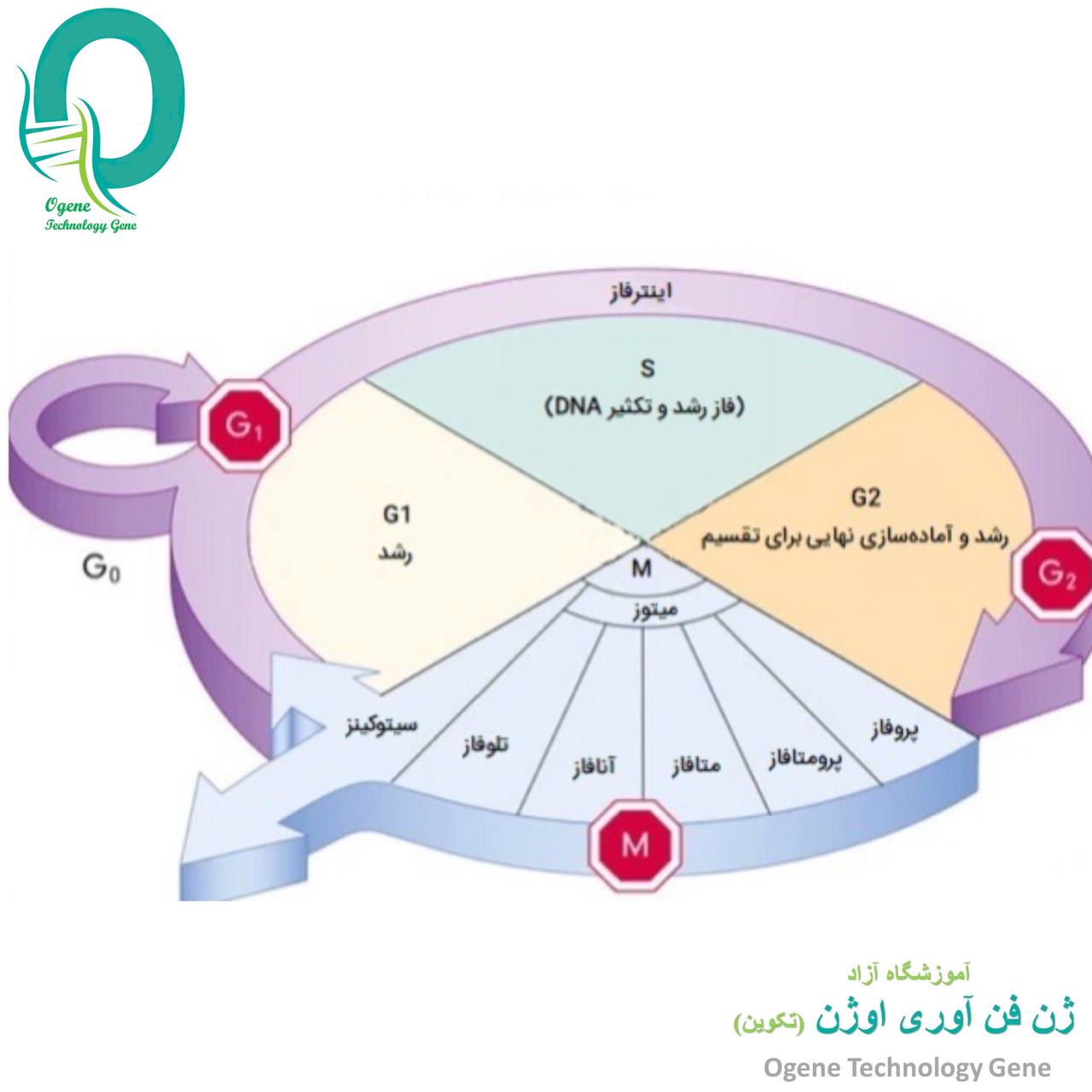
چرخهی سلولی چرخهی زندگی یک سلول است. این چرخه شامل مجموعهای از مراحل رشد و تکامل که سلول از زمان تقسیم از سلول مادری تا تقسیم دوباره برای ایجاد دو سلول در آن باقی خواهد ماند، است. همه ی ارگانیسمها از انسان و گیاهان گرفته تا باکتری ها این چرخه را دائما تکرار می کنند.
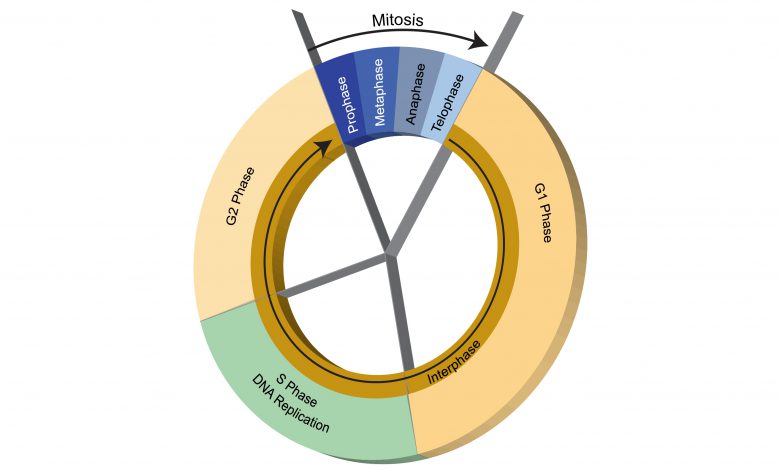
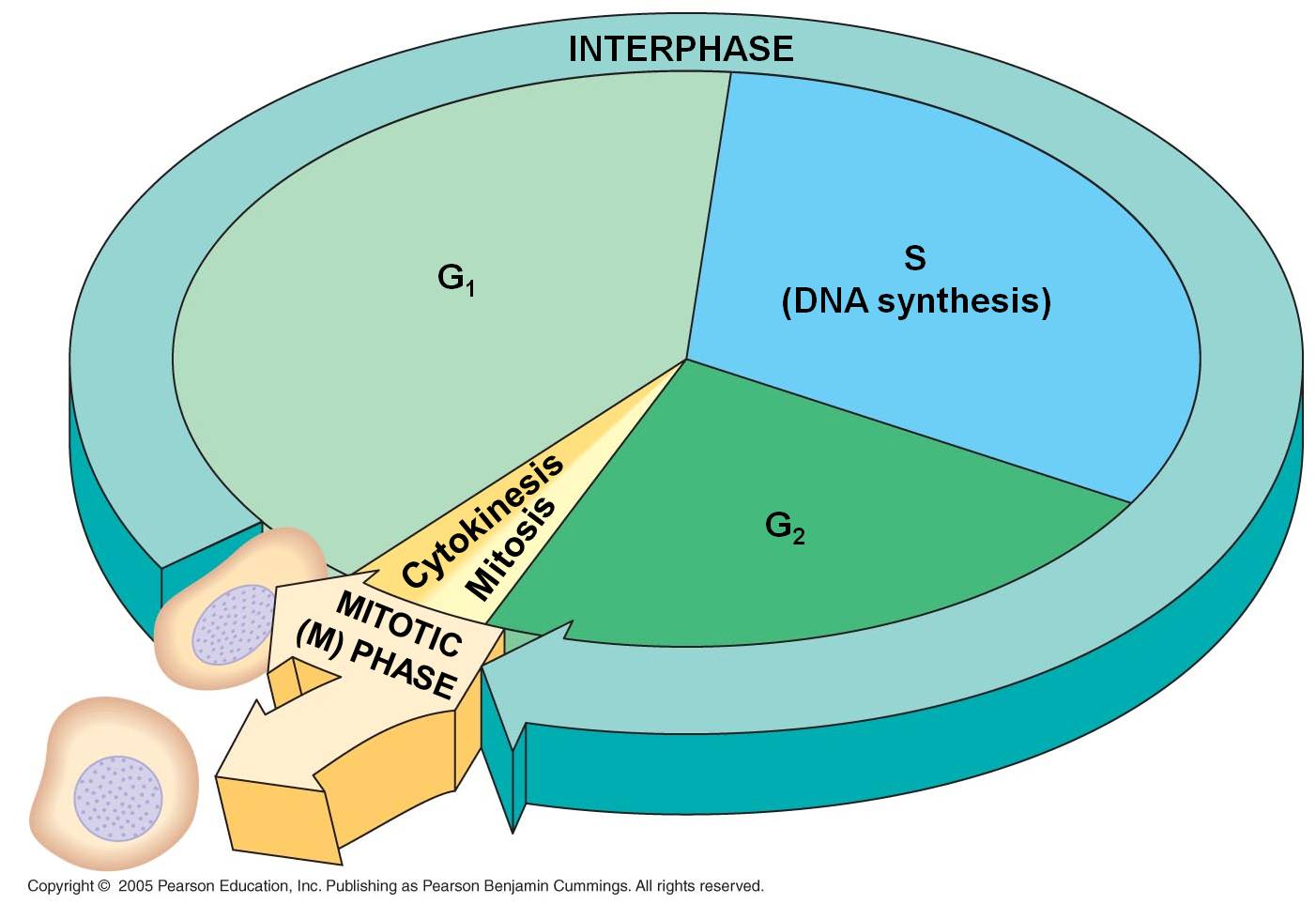
چرخهی سلولی شامل چهار مرحلهی G1، سنتز، G2 و میتوز است.
فرآیندهای چرخه توسط عملکرد متقابل سیکلینها با کینازهای وابسته به آن تنظیم میشود. این چرخه توسط مهارکنندههایی مانند RB و P53 متوقف میشود.
مرحله (G1 (GAP1
- در مرحلهی G1 سلولها میتوانند در جهت سنتز DNA و تقسیم سلولی دیگر پیش روند و یا اینکه چرخهی سلولی به شکل برگشتپذیر (G0) و یا برگشت ناپذیر تمایز یابد، به نحوی که در این مرحله وجود نقاط تنظیمی خاص میتواند سرنوشت سلول را برای تمایز و یا وارد شدن به چرخه سلولی تعیین کند.
مراحل (G2 (GAP2 و سنتز (S)
- در مرحلهی G2 و S وجود نقاط کنترل بینقص بودن DNA را تایید میکنند. در صورت وجود نقص در آن چرخهی سلولی به سمت تعمیر و یا مرگ برنامهریزی شده ( آپوپتوز) پیش خواهد رفت. آپوپتوز به روشهای مختلف در تکنیکهای آزمایشگاهی سلولی قابل تشخیص می باشد.
تمایز
- با افزایش تکثیر، بیان مارکرهای تمایز محدود میشود، پس برای القاء تمایز در تراکم سلولی بالا، افزایش میان کنش سلول- سلول، سلول-ماتریکس و وجود مارکرهای تمایز، مانع تکثیر سلول و القای تمایز میشود.
چرخه سلولی
عوامل موازنه مرگ سلولی از دیدگاه هموستاز بافتی، تکثیر سلول است. سلولهای در حال تکثیر طی فرآیندی که چرخه سلول نامیده میشود متناوباً رشد کرده و تقسیم میشوند. چرخه سلولی از چهار فاز مجزا تشکیل شده است. سلولهای موجودات پیشرفته (Eukaryotes) در فاصله بین دو تقسیم متوالی، مراحل پیوستهای را كه بهطور عمده S,G1 و G2 نامیده میشوند طی میکنند كه اینترفاز (میان چهر) نامیده میشود.
مجموعه اینترفاز كه در خلال آن سلول رشد میکند و تقسیم سلولی (میتوز) كه در آن هسته و سپس بقیه سلول تقسیم میگردد، چرخه سلولی (Cell Cycle) خوانده میشود. مهمترین مرحله بهاحتمال قوی فاز S؛ وقتیکه DNA همانندسازی میکند و فاز M؛ وقتیکه سلول به دو سلول دختری تقسیم میشود، است. هنگامیکه سلول تصميم به تكثير ميگيرد، وارد فاز G1 میشود. در طي ايـن فـاز سـلول بـا ساختن ريبونوكلئيك اسيد آمادگي لازم جهت توليد دزوكسي ريبونوكلئيك اسيد را بهدسـت مـيآورد، به همين دليل به اين مرحله فاز پيشساخت هم گفته میشود.
مدت زماني كه سلول در اين مرحله طي میکند بين 18 تا 30 ساعت بوده و بيشتر از ساير مراحـل طـول میکشد. پس از آنكه سلول با ساخت پروتئینهای ريبونوكلئيـك اسـيد، آمـادگي لازم جهـت توليـد دزوكسي ريبونوكلئيك اسيد را بدست آورد، وارد فاز S میشود. در اين مرحله دزوكسي ريبونوكلئيك اسيدهاي موجود در هسته دو برابر میشوند. اين مرحله بـين 18 تـا 20 سـاعت طول میکشد. پس از اتمام فاز S، سلول وارد مرحلة G2 میشود. در اين فـاز سـلول انـرژي لازم جهت دو تا شدن را كسب میکند. فاز G2 بين 2 تا 10 سـاعت میتواند بطـول انجامد. نهايتاً در فاز M يك سلول به دو سلول همسان تقسيم میشود. اين مرحله بسيار كوتاه می باشد و حدود 30 تا 60 دقيقه به طول میانجامد.
پـس از تقـسيم شـدن سـلول بـه دو سلول همـسان، سلولهای جديد میتوانند دوباره وارد فاز G1 شده و به تكثير ادامه دهند و يـا وارد فـاز G0 شـده و بـه جمعيت ساكن ملحق شوند.
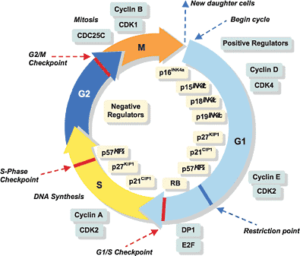
در سلولهای يوکاريوتی شبکه پیچیدهای از پروتئینهای تنظيمی با نام سيستم کنترل چرخه سلولی ايجاد شده است که انجام صحيح مراحل چرخه سلولی را کنترل میکند. در قلب اين سيستم کنترلی، گروهی از پروتئين کينازها وجود دارند که با فسفوريلاسيون پروتئینهای درون سلولی موجب شروع، پيشبرد و يا تنظيم مراحل مختلف چرخه سلولی میشوند. فعاليت اين پروتئين کينازها بهصورت چرخهای افزايش و کاهش مییابد و هميشگی نيست. تنظيم فعاليت چرخهای اين پروتئين کينازها برعهده مجموعهای از پروتئینها و آنزیمها می باشد که مهمترین آنها پروتئینهای کنترلی ویژهای به نام سيکلينها (cyclin) هستند و به همين دليل به پروتئين کينازهای ذکرشده اصطلاحاً پروتئين کينازهای وابسته به سيکلين (cdk) گفته میشود.
چرخــه ســلولي بهوسیله ژنهـــــــای پايــه چرخــه ســلولي و عوامـــل رونويســـي Transcription factors (TFs) متعددي كنترل میشوند. ژنهای پايــه چرخــه ســلولي شــامل ژنهای كيناز وابسته به سايكلين (CDKs)، ژنهای كيناز فعالکننده و ژنهای بازدارنــده CDK میباشند. پيشرفت چرخـه سـلولي از طريق توليد و تجزيه سايكلينها كنترل میشود. میزان بيان ژنهای رمزكننده سايكلينها در چرخه سلولي متغیر تعیینکننده اصـلي زمـان فعاليـت ژنهای CDK اسـت. سايكلينها به دوگروه سايكلينهاي ميتوزي نوع A و Bو سايكلينهاي اختصاصي مرحله G1 تقسیمبندی میشوند.
اکثریت سلولها در بدن انسان در حالت چرخه نیستند و بهجای آن در حالت خارج از چرخه زندگی میکنند. تعداد کمی از سلولها در چرخه فعال هستند و این سلولها معمولاً stem cellها میباشند یا در بافتهایی مثل اپیتلیوم و مغز استخوان که قابلیت خودنوسازی دارند، هستند.
در مقابل، عملکرد اکثر سلولها حالت غیرقابل برگشتی دارد که از حالت چرخه سلولی به حالت انتهایی تمایز (مثل نورونها، مایوسیتها یا موکوس پوست) یا حالت برگشتپذیر به چرخه حالت خاموشی (حالت G0) میباشد.
پیرامون چگونگی تنظیم رخدادهای پیوستهای كه در خلال مراحل چرخه سلولی رخ میدهد در چندین دهه گذشته، مطالعات بسیار گستردهای صورت گرفته است كه با رشدی فزاینده ادامه دارد و البته، در مسیر درك آن، سرنخهای بسیار مهم بهدستآمده است. به دلایل فراوان، این پژوهشها از جمله برای فهم عمیق و مولكولی چگونگی فرایند رشد و تكثیر سلول- طبیعی و غیرطبیعی-، ایمنی سلول و ترمیم بافتی، در محورهای پایهای و كاربردی از اهمیت اساسی برخوردار است. این پژوهشها، همچنین در پزشكی مولكولی كاربردهای پرشماری دارد كه طراحی روشهای كارآمد جهت پیشگیری از تكثیر بیرویه سلولهای سرطانی -كه در آنها نقش كنترلی تنظیمکنندههای چرخه سلولی و رشد، به نحوی زایل شده است- و احتمال ابداع شیوههای نو برای القاء تكثیر سلولهای موردنیاز در تجدید اعضای بافتهای آسیبدیده- احتمالاً مشتمل بر نورونهای بالغ كه تقسیم نمیگردند- از آن جمله است.
چرخة سلولی، مهمترین موجودیت برای بقاء سلول است. عوامل و پروتئینهای فراوان در نقشهای مثبت یا منفی در نقاط و گلوگاههای متعدد، این چرخه را بهطور دقیق و هماهنگ، تنظیم و كنترل میکنند. درواقع، در سلولها، ژنهای متنوعی حضور دارند كه پروتئینهای لازم برای كنترل چرخة سلول را رمزدهی میکنند.
پروتئین RB نقش حیاتی در تنظیم گذر از G1 به S ایفا میکند. پروتئین RB مستقیماً فعالیت E2F را که بیان چندین ژن موردنیاز برای فاز S نظیر سایکلین E که سایکلین اصلی فاز S است را کنترل میکند. پیش از فاز S, E2F به پروتئین RB غیر فسفریله متصل است. E2F در شکل متصلشده نمیتواند با پروموترهای ژنی همراه شود، در این حالت به لحاظ عملکردی ناکارآمد است.
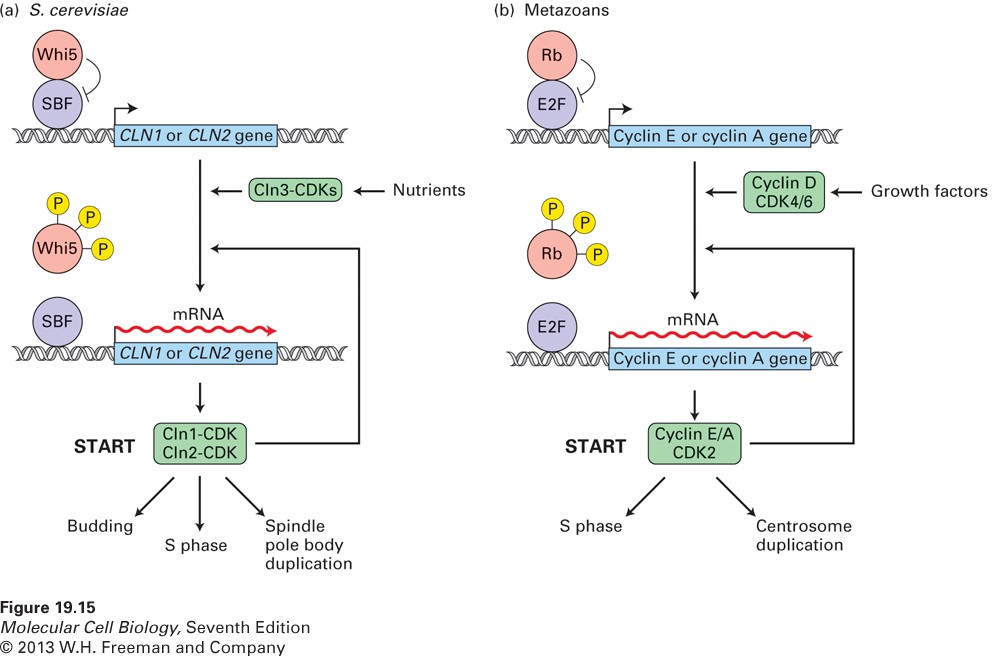
رونویسی از ژن سایکلین D در ابتدای فاز G1 در بیشترین مقدار است. در انتهای فاز G1، سایکلین D که در حال جمع شدن است فعال شدن CDKهای 4 و 6 را که RB را غیرفسفریله میکنند، تحریک مینماید. فسفریلاسیون RB، کمپلکس E2F-RB را از بین میبرد و این امکان را برای E2F فراهم میکند که ژنهای هدف خود را نظیر CCNE که سایکلین E را فعال میکند ،رمزدهی نماید. کمپلکس CDK2/E نیز RB را فسفریله میکنند که باعث تسریع تولید سایکلین E و درنتیجه گذر به فاز S میگردد.
تجمع سایکلین D در فاز G1 با این سازوکار موج بعدی سایکلین E را ایجاد میکند که سلول را به فاز S میراند.
با آنكه چرخة سلولی در ایستگاههای متعددی كنترل و بازرسی میشود، این تنظیم بهویژه در دو نقطه با شدت و مراقبت خارقالعادهای صورت میگیرد. سلول، در نقطه نخست، پیرامون همانندسازی DNAی خود و در نقطه دیگر، برای شروع تقسیم میتوز، تصمیمگیری میکند. این مراحل در قلمرو عبور از G1 به S و از G1 به M اسـت.
مراحل گذار، با كنترل ژنتیكی سلول، بهعنوان نقاط بازرسی بهطور هماهنگ وارد عمل میشوند و موجبات بقای سلول به حالت طبیعی را فراهم میآورند. بهعنوان نمونه، در این نقاط بهمنظور بقای سلول، آسیب احتمالی وارده به DNA در حداكثر توان، تشخیص داده شده و راهكارهای لازم برای رفع آن- یعنی مرمت آسیب- تدارك دیده میشود. شایان تأکید است كه در سلولهای توموری، نقاط كنترل چرخه سلولی، چندان شناسایی نگردیده است.
از جمله ژنهایی هستند كه غیرفعال شدن آنها باعث بیثباتی در نقلوانتقال كروموزومي میگردد. P53 در ابتلا به سرطانهای مختلفي از جملـه سـرطان پستان، ساركوم، تومورهاي مغزي، لوسمي، كارسينويم آدرنوكوريتكال بهصورت ارثي و بـدخيم نقـش ايفا میکند. غالباً جهش در اين ژن در مراحل بعدي سرطان اتفاق میافتد و باعث افـزايش بیثباتی كروموزومي میگردد. جهش ژن P53 در سلولهای سوماتيك (بالغ) پستان، در بيش از 50 درصد از سرطانهای غيروراثتي پستان ديده شدهاند.
نقاط کنترل چرخه سلول شامل سه Check point است:
۱)G1/S Check point : از همانندسازی کروموزوم آسیبدیده جلوگیری میکند.
۲) G2/M Check point: از جدا شدن کروموزومهایی که همانندسازی آنها در طی میتوز کامل نشده ممانعت بهعمل میآورد.
۳) spindle check point: نقاط کنترلی از متافاز به آنافاز است که بررسی میکند آیا همه کروموزومها به دوک تقسیم متصل شدهاند یا نه
بیش از 26000 موتاسیون ژنتیکی در ژن p53 گزارش شده است. بیشتر این موتاسیونها در ناحیه DNA-binding اتفاق میافتد که باعث میشود ژنهای تحت کنترل p53 نتوانند نسخهبرداری نمایند. همکاری پروتئین p53 با دو پروتئین CDK1-P2 و CDC2، سلولهای سرطانی را در مراحل G1 و G2 تقسیم سلولی نگه میدارد. پروتئین p53 هم مهارکننده و هم ارتقادهنده سلولهای سرطانی است. پروتئین p53 پس از صدمات ژنهای دیگر به DNA متصل میشود و باعث تحریک ژن WAF1 میگردد. این ژن، پروتئین P21 را میسازد و به پروتئین CDK2 میچسبد و اجازه ورود P21 به مرحله بعدی تقسیم سلولی را نمیدهد.
پروتئین p53 ترکیبی از شبکه حوادث مولکولی است که در تولید سلولهای سرطانی نقش مهمی را بازی میکند. پروتئین p53 فعال از طرف ترمینال N از دو طریق فسفوریلاسیون میشود؛ از طریق MAPK پروتئین و از طریق ATM و ATR و LHK پروتئین. وقتیکه p53 فسفوریلاسیون میشود خاصیت چسبیدن به MDM2 را از دست میدهد. پروتئین pint باعث تغییر شکل در ساختمان p53 میشود و به عدم اتصال p53 به MDM2 کمک مینماید. وقتیکه ژن p53 فاقد ضربات محیطی است، مقدار p53 پائین میرود. پروتئین MDM2 به p53 میچسبد و از عملش جلوگیری میکند و آن را به سیتوپلاسم سلول انتقال میدهد.
عمل ضدسرطان p53 از سه مسیر انجامپذیر است:
- پروتئین p53 باعث تحریک پروتئینهای ترمیمکننده DNAr میشوند که به صدمات زدهشده به ژنها رسیدگی شود.
- پروتئین p53 باعث تحریک مرگ برنامهریزیشده میشود (وقتیکه سلولهای صدمهدیده غیرقابل بازسازی باشند).
- پروتئین p53 تقسیم سلولی را در مرحله G1/S نگه میدارد تا فرصتی برای تعمیر باشد.
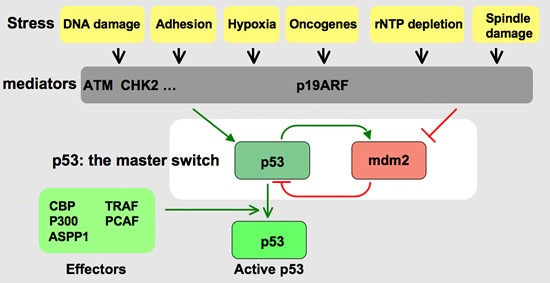
زمانی که آسیبی به DNA وارد شود پروتئین کینازهای ATM و ATR فعال میشوند. این پروتئین کینازها Chk1 و Chk2را فعال میکنند. این کینازها سنس ایجاد شده را به P53 انتقال میدهند و آن را فسفریله میکند.p53 به Mdm2 متصل است. Mdm2 نیز اثر مهاری بر P53 دارد. درنتیجه P53 فعال شده و بهعنوان یک فاکتور رونویسی، رونویسی از چندین ژن از جمله P21 را افزایش میدهد، که این فاکتور باعث مهار چرخه سلول در مرحله G1 میشود.
دو داروی Nutlin (سیس ایمیدازولین) که از واکنش بین MDM۲ و p53 جلوگیری میکند و Teno Fix در نهایت موجب جلوگیری از رشد سلولهای سرطانی میشوند. اولین بار در سال 1996 ژندرمانی با استفاده از ژن p53 در یک رتروویروس حملکننده انجام شد. این ویروسهای حامل ژن طبیعی p53 در محل سلولهای سرطان شش تزریق شد و این آزمایشهای بالینی تا مرحله سوم پیشرفت نمود ولی متأسفانه سازمان FDA آمریکا آن را تصویب نکرد. در حال حاضر این آزمایشها در کشور چین انجام میگیرد. وظایف پروتئین p53 در هسته سلول مشخص است ولی هنوز در سیتوپلاسم کاملاً مشخص و مطالعه نشده است
- spindle check point: کروموزومهای متافازی در سانترومر توسط چیزی شبیه به حلقه به نام کروماتین نگه داشته میشوند. پروتئینی به نام cdc20 باعث جداسازی کروموزومهای خواهری میشود. cdc20 یوبی کوئیتین لیگازAPC/C را فعال میکند که APC/C پروتئین سکورین را یوبیکوئیتینه میکند. سکورین از عمل آنزیم سپاراز جلوگیری میکند. سکورین توسط پروتئازوم تجزیه میشود. سپارا Scs1 کوهزین را میبرد که نتیجهاش جداسازی کروماتیدهای خواهری در قطب دوک است.
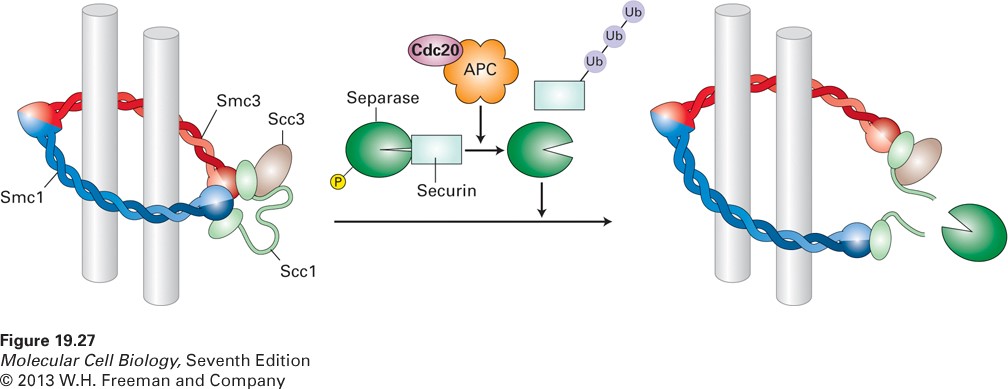
برای جلوگیری از جدا نشدن کروموزومها یک مکانیسم تنظیمی که درست قبل از آنافاز است توسط Mad2 انجام میشود.
Mad2 به کینه توکور کروموزومی متصل میشود که به میکروتوبول دوک میتوزی متصل نیست. اتصال به کینه توکور Mad2 را فعال میکند و Mad2 بهنوبه خود از فعالیت Cdc20 جلوگیری میکند که Cdc20 کنترلکننده APC/C است.
مطالعات گسترده نشانگر رابطهای دقیق و پیـــــــــــــــــــــــــچیده بین”ساعت چرخــه سلولی” (The Cell Cycle Clock) و سرطان است. چنانكه پیشتر تأکید شد، اكثر – و احتمالاً عموم- سرطانهای انسانی رشدی بیرویه دارند. این رشد غیرعادی هم به دلیل آشفتگی و انحراف در مسیرهای علامترسانی در سلولها و هم به دلیل برهم خوردن نظم ساعت چرخه سلولی است. ساعت مورد اشاره- مشتمل بر اجتماعی از پروتئینهای برهمکنش كننده در هسته- بهعنوان مدیریت تصمیمگیر سلول وظائف حیاتی خود و از جمله تصمیمگیری برای عبور سلول از چرخه سلولی را انجام میدهد. بدیهی است هرگونه اختلال در عملكرد طبیعی دقیق و پیچیده آن، میتواند در مسیر پیدایش سرطان نقش كلیدی ایفا كند.
برنامههای ساعت چرخه سلولی درواقع ردیفی از مراحل و رخدادهای بههمپیوسته را با واسطه انواع متنوعی از مولکولها انجام میدهد. درواقع در روند چرخه، فرآوردههای پروتئینی مربوط به ژنهای خاصی در تنظیم دقیق چرخه سلولی نقشهای تقویتکنندگی یا مهارکنندگی را برعهده دارند. از میان این مولکولها، دو ملكول پلیپپتیدی به نامهای سیكلینها (Cyclins) و پروتئین كینازهای وابسته به سیكلین یا بهاختصار Cycline Dependent Protein Kinases) CDKs) و در ارتباط با یكدیگر، در فرآیند آغازسازی و ورود به مراحل متنوع چرخه سلولی- و بهعنوان آغازگرهای اصلی برای عبور از یک مرحله به مرحله دیگر چرخه- از اهمیت اساسی برخوردار هستند.
بهطور نمونه، در مرحله G1 سیكلینهای نوع D به پروتئین كنیازهای وابسته به سیكلینهای نوع 4 و 6 متصل شده و در نتیجه آن، این مجموعه بر روی مولكول قدرتمند بازدارنده رشد- به نام پروتئین PRB- عمل میکند. این عمل، موجبات رهاسازی اثر ترمزکنندگی این پروتئین را فراهم میآورد و در نتیجه آن، سلول قادر میشود تا وارد مراحل نهایی G1 گشته و از آنجا وارد مرحله S گردد.
برای درك بهتر مطلب، چنانچه چرخه سلولی را بهعنوان یك خودرو فرض كنیم، سیكلینها بهمثابه جاپایی یا پدال گاز خودرو است كه موتور (CDK) را به كار میاندازد. در این خودرو، طبیعتاً ترمز نیز وجود دارد تا در شرایط نامناسب (و ضروری)، چرخه سلولی را از فعالیت بازدارد. پروتئینهای اتصالی درواقع نقش این ترمز را دارند و قادر هستند از فعالیت پروتئین كینازی سیكلین ها جلوگیری كنند. پروتئینهای اتصالی كه به نام بازدارندههای پروتئین كینازهـــــــــــــــای وابسته به سیكلین (Cycline Dependent Protein Kinase inhibitors) خوانده میشوند، چرخة سلولی را در نقطه بازرسی متوقف میکنند. اگرچه، بهمجرد دریافت چراغ سبز از مکانیسمهای کنترلکننده، كه مفهوم آن آمادگی كامل سلول برای ورود به مرحله بعدی چرخه است، این مانع برداشته میشود.
پژوهشگران پروتئینهای بازدارنده متنوعی را شناسایی كرده و عملكرد آنها را در خلال چرخه ســلولی بهطور وسیعی مطالعه و مورد شناسایی قرار دادهاند، بهطور مثال P15 و P16 كه هر دو فعالــــیت CDK– شریك سیكلین D– را سد میکنند و درنتیجه مانع ورود سلول از مرحله G1 به مرحله S میشوند.
P57,P53,P27,P21,P18 نمونههای دیگری از این پروتئینهای بازدارنده هستند كه بهویژه P53 با عملكردهای متنوع در جلوگیری از پیدایش سرطان اهمیت بسزایی دارد، زیرا دستکم در نصف تمام تومورهای انسانی، فقدان پروتئین طبیعی P53، بارها گزارش گردیده است.
فرآیند كنترل منفی یا بازدارندگی فعالیت CDK كه در نقاط بازرسی سلول در مراحل G1 و G2 صورت گیرد، بهعنوان اهرم ترمز عمل میکند، بهطور مثال در زمانی كه ملكول DNA در خلال مرحله G1 توسط عاملی مانند پرتو ایكس آسیب میبیند، شرایطی فراهم میآید كه طی آن درستی همانندسازی DNA و دیگر فرآیندهای اصلی سلول تضمین گردد. برروی هم، بیان و میانكش سه نوع مولكول؛ سیكلینها، CDKs و بازدارندههای آنها در گستره وسیع و در مأموریتهای مهمی مانند زمانبندی رخدادهای چرخه سلولی و تصمیمگیری سلول برای فرآیند همانندسازی و تقسیم نقش اساسی دارند. پروتئینهای بازدارنده اشارهشده در بالا و مانند آنها، در شرایط طبیعی، سلامت همانندسازی DNA و درستی چرخة سلولی را تضمین میکنند، طبیعتاً جهش در ژنهای مسبب آنها یا در ژنهایی كه بیان یا فعالیت آنها را تنظیم میکنند، در پیدایش سرطان نقش محوری دارد.
مسیرهای ملکولی مختلفی در پیشبرد سیکل سلولی نقش دارد.
- مسیر PI3K/AKT:
یکی از این مسیرها، مسیر PI3K/AKT است که یک فعالکننده قوی سایکلین D است و تأثیرگذار اصلی پیشرفت سیکل سلولی است.
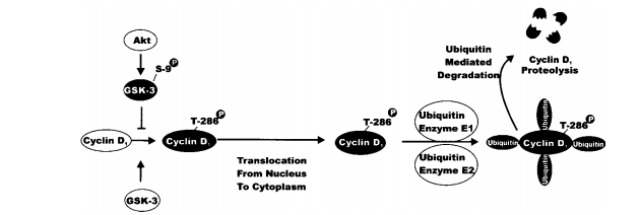
مقدار پروتئین سایکلین D توسط GSK3 تنظیم میشود.
سایکلین D از طریق پروتئولیز وابسته به یوبی کوئیتین تجزیه میشود که این عمل توسط فسفریلاسیون در ناحیه T286 از سایکلین D صورت میگیرد و توسط آنزیمهای E1 و E2 تجزیه میشود. پروتئین GSK3 ناحیه T286 از سایکلین D را فسفریله میکند که فسفریلاسیون در این ناحیه علاوه بر تجزیه آن باعث انتقالش از هسته به سیتوپلاسم و در نتیجه غیرفعال شدنش میشود.
PI3K/AKT باعث فسفریله شدن پروتئین GSK3 میشود. درنتیجه این پروتئین را غیرفعال میکند.
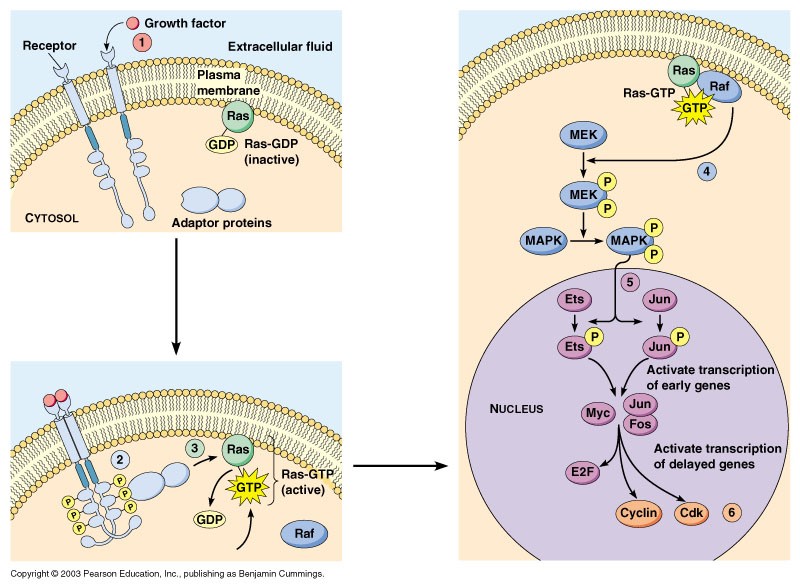
- مسیر Ras
وقتی لیگاندی مانند EGF بر روی رسپتورش مانند EGFR مینشیند، مسیرهای مختلفی برای پیشبرد سیکل سلولی فعال میشود. یکی از این مسیرها Ras است که در بسیاری از سرطانها جهش دارد. فعال شدن RAS باعث فسفریله و فعال شدن RAF میشود، به دنبال آن RAF کیناز MAP را فعال کرده و آبشاری از کینازها به راه میافتد که در نهایت باعث فعال شدن فاکتور رونویسی MYC شده که در نتیجه MYC باعث افزایش بیان سایکلین D میشود، همچنین MYC باعث افزایش تجزیه و افزایش فعالیت E2F و فسفریلاسیون و غیرفعال شدن Rb شده که همه این عوامل باعث پیشبرد سیکل سلولی میشود.
اثر MiRNA بر سیکل سلولی
MiRNA نقش بسیار مهمی در پیشبرد یا عدم پیشبرد سیکل سلولی بازی میکند.MiRNA هایی که باعث مهار سیکل سلولی میشوند بهعنوان تومور ساپرسور شناخته میشوند. در مطالعهای نشان داده شد که MiRNA125a در لوسمی میلوئید حاد کاهش مییابد. در این مطالعه نشان داده شد متیلاسیون نقش بسیار مهمی در خاموشسازی این MiRNA را دارد، زیرا نواحی CpG زیادی در ناحیه پروموتر این MiRNA وجود دارد که متیلاسیون این نواحی باعث خاموشسازی این MiRNA میشود.
MiRNA125a مسیر ErbB را مهار میکند که این رسپتور ترانس ممبران در پیشبرد چرخه سلولی نقش دارد و باعث شدن فعال شدن مسیر PI3K/AKT و STAT5 میشود که در نهایت باعث تقسیم سلولی میشود.
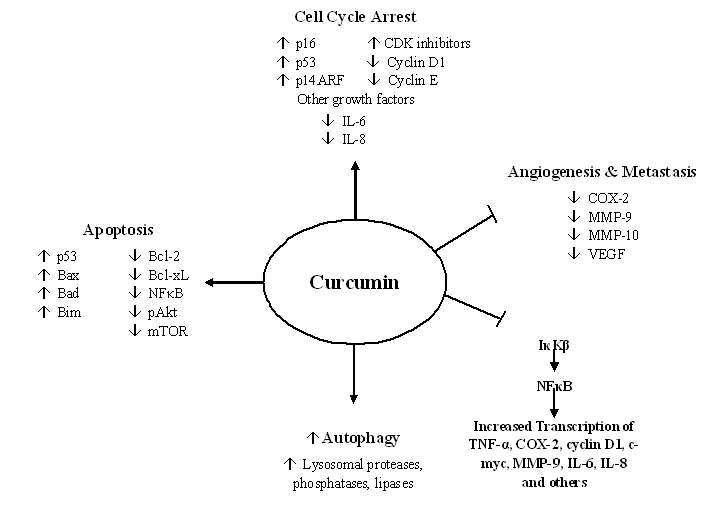
اثر کورکومین بر سیکل سلولی
کورکومین قرنهاست که بهعنوان یک داروی ضد سم در درمان سرطان بکار میرود. کورکومین یک رنگیزه زرد است که از زردچوبه به دست میآید و دارای خواص ضد سرطانی و آنتیاکسیدانی است. این ماده بر روی انواعی از مسیرهای بیولوژیک درگیر در موتاژنز شامل بیان انکوژنها، تنظیم سیکل سلولی، آپوپتوز و متاستاز هم اثر دارد. کورکومین اثر ضد تکثیری بر سرطان دارد. کورکومین بیان خانواده Cip/Kip را برای جلوگیری از عملکرد CDKها افزایش میدهد.