05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
آموزشگاه آزاد نانو زیست فناوری اوژن اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
دوره آموزشی جامع کاربری دستگاه فلوسایتومتری
سرفصل مطالب
- آشنایی با کاربردهای فلوسایتومتری
- اصول و راه اندازی تکنیک
- نحوه کار با روش های رنگ آمیزی
- نحوه کار با دستگاه
- آنالیز داده های فلوسایتومتری
- ظرفیت محدود
- همراه با ارائه مدرک معتبر
ویژگی های آموزشگاه نانو زیست فناوری اوژن (تکوین)
- تمام دوره ها و کارگاه ها با ظرفیت محدود (نهایتا ۴ تا ۵ نفر) برگزار می گردد.
- تمام تکنیک های عملی توسط خود کارآموز بعد از آموزش کامل انجام می شود.
- در پایان دوره های آموزشگاه اوژن می توانید در آزمون فنی حرفه ای شرکت کرده و مدرک فنی حرفه ای دریافت نمایید، که به علت قید ساعت آموزشی برای شما به منزله ی کارآموزی یا کارورزی بوده و در تمام دانشگاه های دنیا معتبر و قابل ترجمه می باشد.
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
instagram.com/ogenetech
مهارت شما آینده شماست
توضیحات
دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
فلوسایتومتری چیست؟
فلوسایتومتری به طور معمول در تحقیقات پایه، آزمایشهای شیمی و آزمایشهای بالینی مورد استفاده قرار میگیرد. فلوسایتومتری (FC) تکنیکی است که برای شناسایی و اندازهگیری خصوصیات فیزیکی و شیمیایی جمعیت سلولها یا ذرات، مورد استفاده قرار میگیرد. در این فرآیند، یک نمونه حاوی سلولها یا ذرات در یک مایع معلق شده و به دستگاه سنجش جریان تزریق میشود.
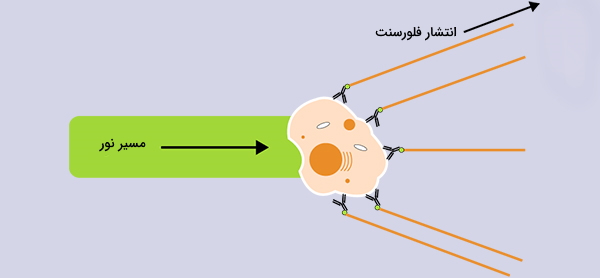
این نمونه طوری تنظیم شده است که به صورت ایدهآل هر بار سلول را از طریق یک پرتوی لیزر جریان دهد، جایی که نور پراکنده مشخصه سلولها و اجزای آن است. سلولها اغلب با مارکرهای فلورسنت برچسبگذاری میشوند بنابراین نور جذب شده و سپس در یک باند از طول موج ساطع میشود.
دهها هزار سلول میتوانند به سرعت مورد بررسی قرار گیرند و دادههای جمعآوری شده توسط رایانه پردازش شوند. موارد استفاده فلوسایتومتری عبارتند از: شمارش سلولها، مرتبسازی سلولها، تعیین خصوصیات و عملکرد سلولها، تشخیص میکروارگانیسمها، تشخیص بیومارکرها، مهندسی پروتئین و تشخیص اختلالاتی مانند سرطان خون. آنالایزر فلوسایتومتری ابزاری است که دادههای کمی را از یک نمونه تهیه میکند. ابزارهای دیگر با استفاده از فلوسایتومتری شامل دستهبندی سلولی هستند که از نظر فیزیکی سلولهای مورد نظر را بر اساس ویژگیهای نوری آنها جدا میکنند.
تاریخچه ابداع فلوسایتومتری
اولین دستگاه فلوسایتومتری مبتنی بر امپدانس، توسط Wallace H. Coulter اختراع و در سال 1953 در ثبت اختراعات ایالات متحده، ثبت شد. مک فولویلر مخترع پیشینی سیلومترهای جریان امروزی، به ویژه طبقهبندی سلولی بود. فولویلر این مسئله را در سال 1965 با انتشار در ژورنال Science منتشر کرد. اولین دستگاه جریان سنجش جریان فلورسانس (ICP 11) در سال 1968 توسط ولفگانگ گوهده از دانشگاه مونستر ساخته شد، در 18 دسامبر 1968 ثبت اختراع شد و اولین بار در سال 1968/69 توسط توسعه دهنده و تولیدکننده آلمانی به نام «Partec» تجاری شد.
در آن زمان، روشهای جذب هنوز به طور گستردهای مورد پسند سایر دانشمندان نسبت به روشهای فلورسانس بودند. اندکی بعد، ابزارهای فلوسایتومتری از جمله موارد زیر ابداع شدند:
- Cytofluorograph از «Bio/ Physics Systems Inc» در سال ۱۹۷۱
- PAS 8000 از «Partec» در سال ۱۹۷۳
- اولین ابزار FACS (مرتبسازی سلول فعال شده با فلورسانس) از بکتون دیکینسون در سال 1974
- ICP 22 از «Partec» در سال ۱۹۵۵
- Phywe از «Coulter» در سال 1977
اولین سیتومتر جریان امپدانس با فرکانس بالا بدون برچسب بر اساس آزمایشگاه روی تراشه میکروسیال ثبت شده، Ampha Z30، توسط Amphasys (2012) معرفی شد. نام اصلی فناوری فلوسایتومتری مبتنی بر فلورسانس، بر اساس اولین کاربرد ثبت اختراع در فلوسایتومتری مبتنی بر فلورسانس «سایتوفوتومتری پالس» بود. در پنجمین کنفرانس بنیاد مهندسی آمریکا در سیتولوژی اتوماتیک در پنساکولا (فلوریدا) در سال 1976 هشت سال پس از معرفی اولین فلوسایتومتر مبتنی بر فلورسانس (1968) – توافق شد که معمولاً از نام فلوسایتومتری استفاده شود، اصطلاحی که به سرعت محبوب شد.
اجزای دستگاه فلوسایتومتری چه هستند؟
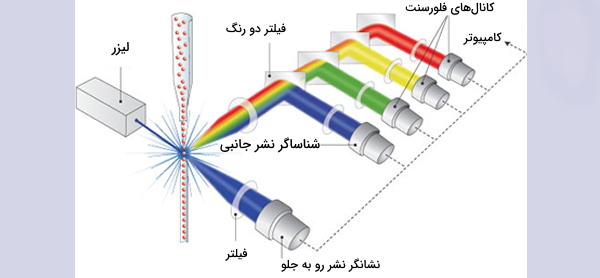
دستگاه فلوسایتومتری از سه سیستم اصلی سیال، اوپتیک و الکترونیک تشکیل شده است. سیستم سیالات شامل یک سلول جریان است که در آن مایعات نمونه تزریق میشوند. سلول جریان برای حمل و تراز سلولها یا ذرات به مایع غلاف نیاز دارد تا آنها ار یک کانال باریک عبور کنند و در یک فایل واحد به داخل مسیر لیزر برسند. این تمرکز هیدرودینامیکی امکان تجزیه و تحلیل همزمان یک سلول را با به کار گرفتن لیزر فراهم میکند. سیستم نوری از فیلترهای مختلف، آشکارسازهای نور و منبع نور تشکیل شده است که معمولا یک خط لیزر هستند و یک طول موج نوری را یا فرکانسی خاص تولید میکنند که محل عبور ذرات از حداقل یک پرتوی لیزر است.
لیزرها در طول موجهای مختلف ماوراءبنفش تا فروسرخ در دسترس هستند و همچنین دامنه متغیر سطح قدرت (خروجی فوتون/ زمان) دارند. پرتوی لیزر هر پروب فلورسنت سازگاری را که با آنتیبادیها متسل شده است تحریک میکند و باعث میشود که پروبها در طول موجهای مشخص شده، نور منتشر کنند.

سیگنال های نوری فلوسایتومتری
این سیگنالها در دو حالت پراکنده به جلو و پراکنده جانبی هستند. پارامترهای اصلی که توسط دستگاه فلوسایتومتری اندازهگیری میشوند عبارتند از:
- پراکندگی نور جلو (FSC)
- پراکندگی نور جانبی (SSC)
- سیگنالهای انتشار فلورسانس
سیگنال نور پراکنده رو به جلو، نوری است که توسط سلول در جهت جلو شکسته میشود و در همان جهتی که نور در حال حرکت بود ادامه مییابد (به طور معمول تا ۲۰ درجه از محور پرتو لیزر جابجا میشود). این سیگنال توسط PMT به نام کانال پراکندگی رو به جلو جمعآوری و معمولا برای تعیین اندازه ذرات استفاده میشود. معمولا ذرات بزرگتر نسبت به ذرات کوچکتر نور پراکنده به جلو تولید میکنند و سلولهای بزرگتر دارای سیگنال پراکنده رو به جلو هستند.
نور پراکنده جانبی، نوری است که توسط سلولها شکسته شده و در جهتی متفاوت از مسیر اصلی خود حرکت میکند (با زاویه ۹۰ درجه نسبت به خط تحریک اندازهگیری میشود). معمولا اطلاعاتی در مورد دانه دانه بودن و پیچیدگی سلولها فراهم میکند. سلولهایی که دارای دانهبندی و پیچیدگی کم هستند، نور پراکنده جانبی کمتری تولید میکنند، در حالی که سلولهای بسیار دانهای با درجه پیچیدگی داخلی (مانند نوتروفیلها)، منجر به سیگنال پراکندگی جانبی بالاتر میشوند. اگرچه از نظر شکل و اندازه سلولها تحت تأثیر قرار میگیرند اما به غشاها، سیتوپلاسم، هسته و سایر اندامکها حساستر است.
بنابراین با استفاده از تشخیص نور پراکنده رو به جلو و جانبی، جمعیت سلولها را اغلب میتوان بر اساس تفاوت مشخصه در اندازه سلول و دانهبندی تشخیص داد. هر دو اندازهگیری تحت تأثیر عوامل متعددی قرار دارند و SSC و FSC به کیفیت تهیه نمونه نیز بستگی دارند بنابراین برای جمعآوری اطلاعات دقیقتر میتوان از تکنیکهای برچسب زدن فلورسنت یا فلوسایتومتر استفاده کرد.
سیگنال های انتشار نور فلورسنت
نکتهای که باید به آن توجه شود این است که سیگنالهای فلورسنت نیز ممکن است از مواد طبیعی فلوسورساز در سلول مکانند نوکلئوتیدهای پیریدن کاهش یافته (NAD(P)H) و فلاوینهای اکسید شده (FAD) به وجود بیایند که اصطلاحا «اتوفلورسنس» (Autofluorescence) گفته میشود. به طور کلی، سلولهای دانهای بزرگتر به دلیل داشتن مقدار زیادی از ترکیبات فلورسنت، سطح فلورسانس بالاتری دارند. سطح اتوفلورسنس را میتوان با استفاده از کنترل رنگآمیزی نشده تعیین کرد. اغلب داشتن کنترلهای رنگآمیزی نشده یا FMO (فلورسانس منهای یک) کاربرد دارد. FMO کمک میکند تا سلولها را در حین تجزیه و تحلیل دادهها، شناسایی و از آنها استفاده کرد.
انواع نمونه فلوسایتومتری
سادهترین نمونهها براین فلوسایتومتری سلولهای کشت شده، میکروارگانیسمهای آب، باکتری و مخمر هستند. استفاده از خون نیز نسبتا آسان است چون گلبولهای قرمز خون طی فرایند لیز کردن از بین میروند و بعد میتوان انواع گلبولهای سفید را در نمونه شناسایی کرد. برای فلوسایتومتری، سلولهای منفرد باید از بافتهای جامد تولید شوند. این کار با تفکیک بافت انجام میشود. تفکیک مکانیکی برای بافتهایی که به صورت آزاد پیوند میخورند مانند سلولهای چسبنده از کشت بافت، مغز استخوان و بافت لنفاوی به خوبی کاربرد دارند.
در تجزیه مکانیکی، بافت خرد شده از طریق سوزنی طریف به طور مکرر به سوسپانسیون منتقل میشود. همچنین میتوان بافت مورد نظر را از طریق آنزیمی تجزیه کرد که طی آن میانکنشهای پروتئینی و ماتریکس خارج سلولی که سلولها را کنار هم نگاه داشتهاند تخریب میشوند. آنزیمها بر اساس فاکتورهایی مانند pH، دما و سایر فاکتورهایی اینتخاب میشوند که روی عملکرد آنزیم تأثیرگذار هستند.
فلوسایتومتری مستقیم و غیر مستقیم
فلوسایتومتری به صورت مستقیم و غیر مستقیم قابل انجام است. در فلوسایتومتری غیر مستقیم، سلول با یک آنتیبادی اولیه علیه آنتیژن مورد نظر رنگآمیزی میشود و با استفاده از آنتیبادی ثانویه برچسبگذاری شده، آنتیبادی اولیه تشخیص داده خواهد شد. از فلوسایتومتری میتوان اطلاعات زیادی را از جمعیت سلول مانند اندازه، مورفولوژی، پیچیدگی، فنوتیپ و عملکرد جمعآوری کرد. به همین ترتیب، انواع متنوعی از معرفها برای کاربرد فلوسایتومتری خاص در دسترس هستند.
به عنوان مثال، رنگهای غیرقابل نفوذ به غشا و فرآیندهای غشایی DNA مانند 7-AAD و یدید پروپیدیوم (PI) از سلولهای زنده حذف میشوند، و آنها را به عنوان ابزار رایج در ارزیابی سلامت سلول و زنده ماندن سلولها در اختیار میگذارد. DAPI، یک رنگ رایج دیگر، هسته سلولهای زنده و ثابت را رنگآمیزی میکند. در تجزیه و تحلیل مارکرهای سلولی خاص، از مولکولهای فلورسنت معمولاً استفاده میشود. فلورسئین / FITC ،APC، سیانین، PE و TRITC از شناختهشدهترینها هستند، اگرچه مارکرهای جدید به طور مداوم در دسترس هستند.
این فلوروفورها را میتوان با آنتیبادیهای ثانویه یا مولکولهای دیگر مانند پروتئین A، پروتئین G یا استرپتاویدین متصل کرد. پروتئین A و G به ایمونوگلوبولینها متصل میشوند در حالی که استرپتاویدین به آنتیبادیهای متصل به بیوتین متصل میشود. استفاده از چندین رنگ امکان مالتی پلکس و اندازهگیری همزمان چندین آنالیت را فراهم میکند. سایر معرفهای فلوسایتومتری شامل استانداردهایی برای فلوروفورها، انواع سلولها و کالیبراسیون ابزارها است.
زمانی که رنگآمیزی مستقیم غیر عملی باشد، رنگآمیزی غیر مستقیم با استفاده از معرفهای ردیابی ثانویه انعطافپذیری لازم برای استفاده از انواع فلوفورها جهت جایگیری در بیشتر پانلهای جریان سایتومتری را فراهم میکند. از آنجا که مولکولهای آنتیبادی ثانویه متعددی به هر آنتیبادی متصل میشوند، سیگنالها تقویت خواهند شد که یک مزیت مهم برای مشاهده آنتیژنهایی با چگالی کم است. با بهینهسازی دقیق همچنان میتوان با آنتیبادیهای ثانویه رنگآمیزی بسیار خوبی به دست آورد.
با تکثیر سیگنال، تمام اتصالات غیر اختصاصی و اتصالات ناصحیح نیز تقویت میشوند. البته برخی از دستورالعملهای ساده را میتوان برای اطمینان از وجود رنگآمیزی خاص و بهینه برای به حداکثر رساندن نتایج دنبال کرد. در ادامه راهنمای استفاده از رنگآمیزی غیر مستقیم در فلوسایتومتری با معرفهای تشخیصی ثانویه توضیح داده شدهاند.
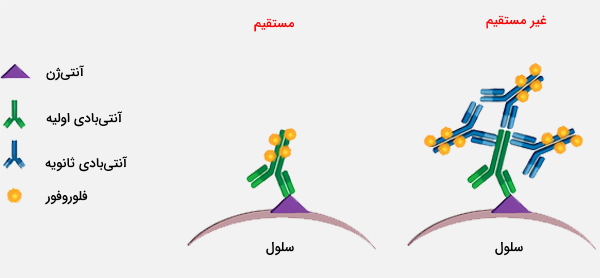
رنگآمیزی ساده آنتی بادی اولیه
هنگام رنگآمیزی نمونهها با آنتیبادی اولیه اتصالی مستقیم، پس از انکوباسیون اولیه و چند مرتبه شستشوی ساده نمونه آماده است. رنگآمیزی غیر مستقیم با استفاده از آنتیبادی اولیه غیر کانژوگه شناسایی شده با آنتیبادی ثانویه، شامل مراحل اضافی زیر است:
- انکوباسیون با آنتیبادی اولیه
- شستشو
- انکوباسیون با آنتیبادی ثانویه دارای برچسب فلورسنت که آنتیبادی اولیه را تشخیص میدهد.
- پس از شستشوی بیشتر نمونه قابل دستیابی خواهد بود.
علیرغم این موارد، اگر ترکیبی از آنتیبادیهای اصلی کونژوگه و غیر کونژوگه وجود داشته باشند که به آنتیبادیهای ثانویه در پانل نیاز دارند، رنگآمیزی پیچیدهتر میشود. برای جلوگیری از اتصال غیر اختصاصی علاوه بر کنترلهای معمول جریان سیتومتری (سلولسنجی)، پروتکلهای رنگآمیزی، مراحل انسداد و شستشو و گزینههای آنتیبادی هم در نظر گرفته میشوند.

ترکیب آنتی بادی های کونژوگه و غیر کونژوگه
یکی از مشکلات رایج هنگام ترکیب آنتیبادیهای کونژوگه و غیر کونژوگه، تشخیص نادرست آنتیبادی اولیه و آنتیبادیهای کونژوگه است که منجر به مثبت کاذب میشود. برای جلوگیری از این مشکل باید بتوان آنتیبادیهای اصلی غیر کونژوگه و کونژوگه را با استفاده از گونهها، کلاس یا ایزوتایپ تشخیص داد. آنتیبادیهای اولیه را میتوان با هم انکوبه کرد، شستشو داد و سپس با آنتیبادیهای ثانویه برچسبگذاری نمود که فقط گونهها، کلاسها و ایزوتایپهای آنتیبادیهای اصلی غیر کونژوگه را تشخیص میدهند.
برای بهینهسازی رنگآمیزی در حالت ایدهآل، هر دو آنتیبادی اولیه و ثانویه باید تیتر شوند تا حداقل زمینه با حداثر سیگنال خاص تضمین شود. همچنین توصیه میشود که کنترل ثانویه فقط برای آنتیبادی و یک کنترل حاوی تمامی آنتیبادیها به جز آنتیبادی اولیه بدون برچسب برای بررسی رنگآمیزی غیر اختصاصی وجود داشته باشند.
مسدود کردن و شستشو
انکوباسیون با یک سرم مناسب، قبل از افزودن آنتیبادیهای اولیه، میتواند با مسدود کردن گیرندههای FC، پس زمینه را کاهش دهد. این گونه باید مشابه با گونه همان سلولی باشد که در حال آنالیز است و هرگز نباید مشابه با گونه مشابه با آنتیبدی اولیه میزبان باشد زیرا آنتیبادی ثانویه سرم مسدودکننده و آنتیبادی اولیه را تشخیص میدهد. اگر از آلبومین سرم گاوی استفاده شود، ممکن است با IgG بووین آلوده شده باشد که با گونههای نزدیک مانند بز و گوسفند واکنش متقابل ایجاد میکند.
برای شستشوی آنتیبادیهای اولیه و ثانویه اضافی، باید مراحل شستشوی کافی در نظر گرفته شوند. برای از بین بردن تمام آنتیبادیهای اضافی به پروتکلهای رنگآمیزی درون سلولی مراحل شستشوی بیشتر و طولانیتری نیاز هستند. علاوه بر این، ممکن است انتخاب نفوذپذیری و بافر شستشو بر روی رنگآمیزی تأثیر بگذارد و باید برای آزمایش بهینه شود.
انتخاب آنتی بادی برای فلوسایتومتری غیر مستقیم
انتخاب آنتیبادی اولیه و ثانویه بر روی طراحی آزمایش تأثیرگذار است. واکنش متقابل گونههای ناخواسته را میتوان با استفاده از آنتیبادیهای ثانویه جذب متقابل یا ایزوتایپ خاص حذف نمود. این کار اطمینان ایجاد میکند که سیگنال از آنتیبادی ثانویه خاص هدف اصلی است. اگر در حال رنگآمیزی بافت ایمنی هستید که حاوی گیرندههای Fc زیادی است، ممکن است بخواهید علاوه بر انسداد با سرم، برای کاهش اتصال غیر اختصاصی یک قطعه F (ab) را به عنوان یک آنتیبادی ثانویه در نظر بگیرید.
در صورت عدم وجود آنتیبادیهای اولیه در گونههای مختلف، ممکن است کلاسهای مختلف ایمونوگلوبولین در دسترس باشند. مثلا IgG و IgM اجازه میدهند که از آنتیبادیهای ثانویه مخصوص کلاس از همان گونه استفاده شود. بسیاری از آنتیبادیهای مونوکلونال اولیه IgG1 و IgG2a موش یا رت یا IgG2b هستند. آنتیبادیهای ثانویه خاص ایزوتایپ امکان مالتی پلکس شدن آنتیبادیهای خالص شده از همان گونه را فراهم میکنند. ممکن است با ترکیب و تطبیق این روشها، گزینههای رنگآمیزی افزایش پیدا کنند اما باید همیشه اطمینان حاصل کرد که آنتیبادیهای ثانویه چندین هدف را تشخیص نمیدهند و کنترلها به درستی انجام شدهاند.
جبران فلورسانس
هنگام استفاده از آنتیبادیهای ثانویه برچسبگذاری شده در یک صفحه چند رنگ، همچنان باید کنترل جبران صحیح فلوروفور ثانویه انجام شود. سادهترین راه انجام کنترل جبران رنگآمیزی منفرد با استفاده از آنتیبادی اولیه غیر کونژوگه و آنتیبادی ثانویه همراه است. اگر این مسئله به عنوان مثال به دلیل بیان کم، مشکلساز باشد، میتوان از دانههای جبرانی استفاده کرد. بر اساس میزان قابلیت اتصال آنتیبادیها، ممکن است امکان استفاده مستقیم از آنها با آنتیبادی ثانویه وجود داشته باشد.
گزینه سوم انجام جبران با استفاده از آنتیبادی اولیه متصل مستقیم به همان فلوفور است که در آنتیبادی ثانویه استفاده خواهد شد. اما استفاده از فلوفورهای متوالی با این روش به دلیل تفاوتها ذاتی بین دستههای متوالی فلوفلور باید با احتیاط فراوان انجام گیرد.
استرپتاویدین به عنوان معرف ثانویه
در صورتی که فقط یک آنتیبادی اولیه بیوتینیله موجود باشد، استفاده از استرپتاویدین با مارکر فلورسنت با چنین آنتیبادی، آن را برای فلوسایتومتری بدون نیاز به آنتیبادیهای ثانویه مناسب خواهد کرد. این گزینه به بررسی واکنش متقابل آنتیبادیهای ثانویه با سایر آنتیبادیهای اولیه را برطرف میکند و میتواند گزینههای رنگآمیزی را هم افزایش دهد. با وجود این همچنان باید کنترلهای منفی و جبران صحیح انجام شوند.
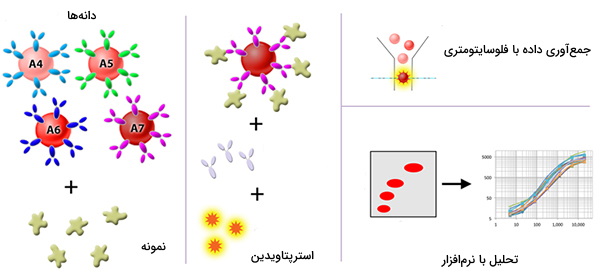
کنترل جریان عمومی
کنترلهای خاصی مانند کنترلهای FMP، ایزوتایپ، زندهمانی، جبران و عدم رنگآمیزی برای فلوسایتومتری نیاز هستند. ساخت پانلهای چند رنگ ممکن است باعث مشکل شده و رعایت دستورالعملهای مربوط به انتخاب ابزار و فلوفور در هنگام انجام رنگآمیزی غیر مستقیم به یک اندازه مهم هستند. علاوه بر این کنترلها و دستورالعملهای استاندارد فلوسایتومتری استفاده از آنتیبادیهای ثانویه ممکن است نیاز به کنترلهای اضافی و بهینهسازی هر دو آنتیبادی و پروتکل رنگآمیزی داشته باشد.
اتصال غیر اختصاصی آنتیبادی ثانویه را میتوان با رنگآمیزی با آنتیبادی ثانویه بدون آنتیبادی اولیه اختصاصی، به تنهایی یا در ترکیب با آنتیبادیهای اولیه که هدف فلوسایتومتری نیستند، ارزیابی نمود. در ادامه میتوان از آنتیبادی اولیه که آنتیبادی ثانویه به آن متصل میشود استفاده کرد، که در نمونه به عنوان منفی شناخته میشود. این کار از جهت اتصال به نمونه و سایر آنتیبادیهای موجود در صفحه، ایده ایجاد میکند و امکان ارزیابی رنگآمیزی غیر اختصاصی پسزمینه را ایجاد میکند.
ابزارهای مورد استفاده در فلوسایتومتری
آنتیبادیهای اولیه به آنتیژنهای مورد نظر متصل میشوند اما برای تشخیص مستقیم برچسبگذاری نمیشوند. معرفهای ثانویه آنتیبادیهای اولیه را هدف قرار میدهند و به صورت ترکیبات مختلفی در دسترس هستند. از معرفهای ثانویه میتوان برای تقویت تشخیص آنتیژنها یا مارکرهایی با بیان کم استفاده کرد زیرا آنتیبادیهای ثانویه پلیکلونال میتوانند در بیش از یک ناحیه به آنتیبادی اولیه متصل شوند و سیگنال ناشی از آن را تقویت کنند.
فلوسایتومترها
انواع فلوسایتومتری مدرن قادر به تجزیه و تحلیل هزاران ذره در ثانیه، در زمان واقعی هستند و در صورت پیکربندی سلولی، میتوانند ذرات دارای مشخصات نوری مشخص را با سرعت مشابه جدا کنند. فلوسایتومتر مشابه میکروسکوپ است، با این تفاوت که به جای تولید تصویری از سلول، فلوسایتومتری کمیت خودکار و پُرقدرت پارامترهای نوری مشخص را بر اساس سلول به سلول ارائه میدهد. برای تجزیه و تحلیل بافتهای جامد، ابتدا باید سوسپانسیون تک سلولی تهیه شود. جریان سنج دارای پنج جز اصلی است:
- سلول جریان: دارای یک جریان مایع (مخزن پوشش دهنده) است، که سلولها را حمل و تراز میکند به طوری که آنها برای سنجش از یک پرتوی نور یک پرونده عبور میدهند.
- سیستم اندازهگیری: سیستم اندازهگیری معمولاً از اندازهگیری امپدانس (یا رسانایی) و سیستمهای نوری، لامپها (جیوه، زنون) استفاده میکند. لیزرهای خنک شده با آب با قدرت بالا (آرگون، کریپتون، لیزر رنگ). لیزرهای با درجه پایین خنک کنندگی هوا (آرگون (488 نانومتر)، HeNe قرمز (633 نانومتر)، HeNe سبز، HeCd (UV))، لیزرهای دیود (آبی، سبز، قرمز، بنفش) و در نتیجه سیگنالهای نوری ایجاد میشوند.
- سیستم ردیاب: سیستم ردیاب و تبدیل آنالوگ به دیجیتال (ADC) اندازهگیریهای آنالوگ نور پراکنده رو به جلو (FSC) و نور پراکنده کناری (SSC) و همچنین سیگنالهای فلورسانس مخصوص رنگ را به سیگنالهای دیجیتالی تبدیل میکند که توسط کامپیوتر قابل پردازش است.
- سیستم تقویت: سیستم تقویت میتواند خطی یا لگاریتمی باشد.
- کامپیوتر برای تجزیه و تحلیل سیگنالها: فرآیند جمعآوری دادهها از نمونهها با استفاده از فلوسایتومتر کسب نامیده میشود. اکتساب توسط رایانهای متصل است که از نظر فیزیکی به فلوسایتومتر متصل است و نرمافزاری که رابط دیجیتال را با سیتومتر کنترل میکند. این نرمافزار قادر به تنظیم پارامترها (به عنوان مثال ولتاژ و جبران) نمونه مورد آزمایش است و همچنین در حین دستیابی به دادههای نمونه، به نمایش اطلاعات اولیه نمونه کمک میکند تا اطمینان حاصل شود که پارامترها به درستی تنظیم شدهاند.
به طور کلی دستگاههای اولیه فلوسایتومتری، آزمایشی بودند اما پیشرفتهای تکنولوژیک اخیر، کاربردهای گستردهای در اهداف بالینی و تحقیقاتی با کمک فلوسایتومتری را امکانپذیر کردهاند. با توجه به این پیشرفتها، بازار قابل توجهی برای ابزار دقیق، نرمافزار تجزیه و تحلیل و همچنین معرفهای مورد استفاده در کسب مانند آنتیبادیهای دارای برچسب فلورسنت توسعه یافتهاند. ابزارهای مدرن معمولاً دارای چندین لیزر و آشکارسازهای فلورسانس هستند. رکورد فعلی یک ابزار تجاری ده لیزر و 30 ردیاب فلورسانس است.
افزایش تعداد لیزرها و آشکارسازها امکان برچسبگذاری آنتیبادیهای متعدد را فراهم میکند و میتواند با استفاده از مارکرهای فنوتیپی آنها، به طور دقیقتری یک جمعیت را شناسایی کند. برخی از ابزارها حتی میتوانند از سلولهای منفرد تصاویر دیجیتالی بگیرند و امکان تجزیه و تحلیل مکان سیگنالهای فلورسنت را در داخل یا روی سلولها فراهم کنند.
سیستم سیال فلوسایتومتر
سلولها باید به طور یکنواخت از مرکز پرتوهای لیزر متمرکز عبور کنند تا خصوصیات نوری سلولها را در هر دمای سنجش اندازهگیری کنند. هدف سیستم سیال حرکت دادن سلولها یک به یک از طریق پرتوی لیزر و در سرتاسر دستگاه است. سیالات موجود در یک فلوسایتومتر با قابلیت مرتبسازی سلول از جریان برای انتقال سلولهای مرتب شده به داخل لولههای جمعآوری یا چاهها نیز استفاده میکنند.
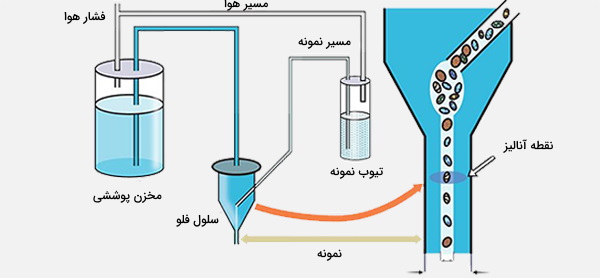
تمرکز هیدرودینامیکی فلوسایتومتر
برای موقعیت دقیق سلولها در یک جهت مایع، از تمرکز هیدرودینامیکی در اکثر سایتومترها استفاده میشود. سلولهای معلق وارد دستگاه محصور شده توسط یک مایع غلاف خارجی میشوند. هسته نمونه در مرکز مایع غلاف نگهداری میشود. میزان ورودی نمونه یا سرعت جریان سلولها در سنجش با لیزر را میتوان با فشار مایع غلاف روی هسته نمونه کنترل کرد. در شرایط مطلوب، جریان مایع مرکزی و مایع غلاف مخلوط نمیشوند.
از فناوری تمرکز صوتی برای پشتیبانی از تمرکز هیدرودینامیکی در برخی از فلوسایتومترها استفاده میشود. امواج صوتی (بیشتر از 2 مگاهرتز) قبل از معرفی مایع غلاف، نمونه را متمرکز میکنند. نمونه متمرکز شده سپس به هسته هیدرودینامیکی تزریق میشود و از طریق دستگاه جریان مییابد. این ممکن است به افزایش دقت دادهها در نرخ ورودی بالای نمونه کمک کند.
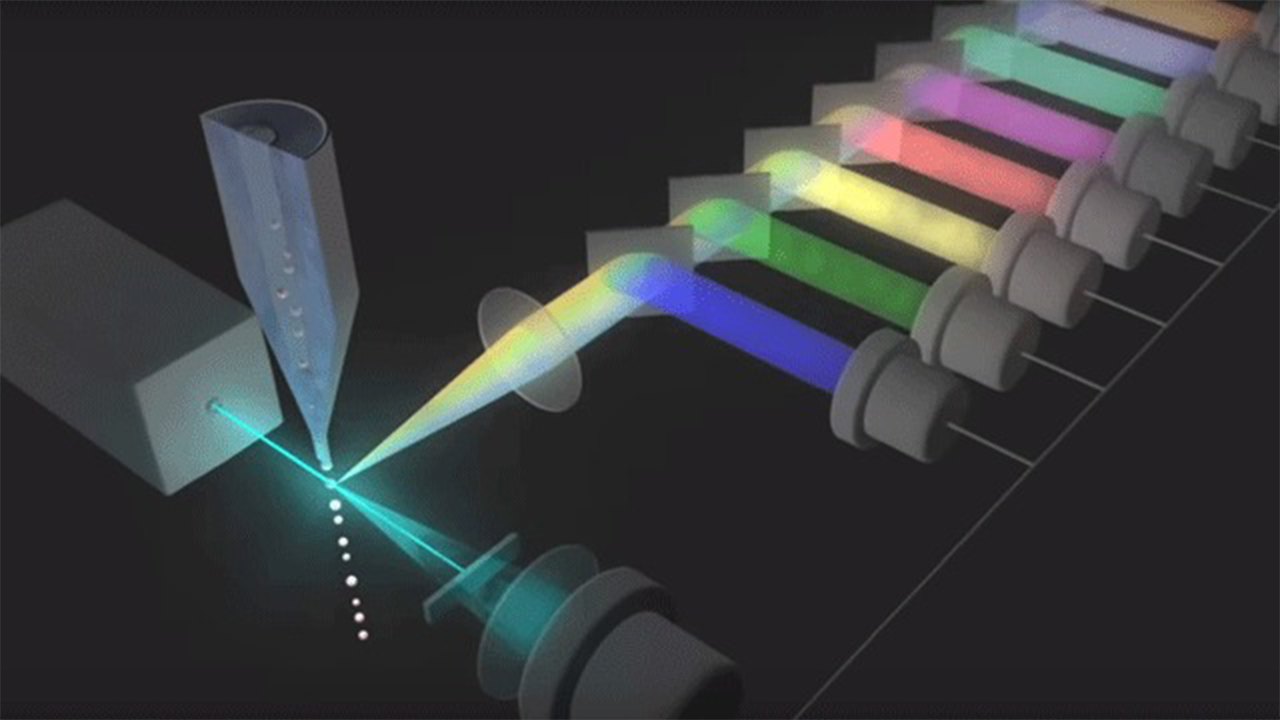
فیلترهای نوری فلوسایتومتر
نوری که از فلوروفورها ساطع میشود در طیف خاصی از طول موج است، بنابراین ترکیب چندین فلوروفور ممکن است باعث همپوشانی شود. برای افزودن ویژگیهای اختصاصی، از فیلترهای نوری و آینههای دیکروئیک برای فیلتر کردن و انتقال نور به آشکارسازهایی مانند لولههای چند برابر کننده نور (PMTها) یا فوتودیودهای بهمنی (APD) استفاده میشود. فیلترهای نوری به عنوان فیلترهای باند گذر (BP)، طولانی گذر (LP) یا کوتاه گذر (SP) طراحی شدهاند. بیشتر سیلومترهای جریان از آینه های دو رنگ و فیلترهای عبور باند برای انتخاب باندهای خاص طیف نوری استفاده میکنند.
منشورها، توری ها و سایتومتری جریان طیفی
فلوسایتومتری طیفی از منشورها یا توری های پراش برای پراکنده کردن نور ساطع شده از یک نشانگر در یک آرایه آشکارساز استفاده میکند. این اجازه میدهد تا طیف کامل از هر ذره اندازهگیری شود. طیفهای اندازهگیری شده از سلولهای منفرد متعاقباً با استفاده از طیفهای مرجع از تمام رنگهای استفاده شده و طیف خود فلورسانس مخلوط نمیشوند. این ممکن است برای طراحی پانل گستردهتر و استفاده از نشانگرهای بیولوژیکی جدید امکانپذیر باشد.
سیتومتری جریان تصویربرداری کمی
سیتومتری جریان تصویربرداری کمی (IFC) تصاویر چند کاناله از سلولها را ضبط میکند. آشکارسازهای مورد استفاده در سیستم عامل های تصویربرداری میتوانند مجهز به دستگاه متصل به شارژ (CCD) یا نیمه هادی فلز اکسید مکمل (CMOS) باشند تا تصاویر سلولهای جداگانه را ضبط کنند.
و …
















Mohamadreza akhbari –
سلام
دوره بسیار کاربردی بود ممنونم