15. کارگاه SDS-PAGE و وسترن بلات
آموزشگاه آزاد نانو زیست فناوری اوژن اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
کارگاه SDS-PAGE و وسترن بلات
سرفصل مطالب:
بخش تئوری
- استخراج پروتئین از سلول های باکتریایی
- معرفی SDS-PAGE (کاربرد و اصول SDS-PAGE)
- آماده سازی نمونه برای SDS-PAGE (نمونه های Supernatant، رسوب باکتری،…)
- روش انجام SDS و بافرهای موردنیاز
- روش های رنگ آمیزی و ارزیابی پروتئین
- معرفی اصول اولیه وسترن بلاتینگ
- انتقال پروتئین از ژل برو روی غشاء نیتروسلولزی
- اتصال آنتی بادی به پروتئین هدف و آشکار سازی هویت پروتئین
- معرفی خطاهای رایج و ارائه راه حل
بخش عملی
- تهیه ژل آکریل آمید
- آماده سازی نمونه برای SDS-PAGE
- بارگذاری نمونه روی ژل SDS-PAGE
- رنگ آمیزی نمونه های SDS-PAGE (کماسی بلو)
- انتقال نمونه ها از ژل به کاغذ نیتروسلولزی
- بارگذاری آنتی بادی اولیه و ثانویه
- آشکارسازی فعالیت آنزیمی آنتی بادی اتصال یافته به پروتئین هدف
- ظرفیت محدود
- همراه با ارئه مدرک معتبر
ویژگی های آموزشگاه نانو زیست فناوری اوژن (تکوین)
- تمام دوره ها و کارگاه ها با ظرفیت محدود (نهایتا ۴ تا ۵ نفر) برگزار می گردد.
- تمام تکنیک های عملی توسط خود کارآموز بعد از آموزش کامل انجام می شود.
- در پایان دوره های آموزشگاه اوژن می توانید در آزمون فنی و حرفه ای شرکت کرده و مدرک فنی و حرفه ای دریافت نمایید، که به علت قید ساعت آموزشی برای شما به منزله ی کارآموزی یا کارورزی بوده و در تمام دانشگاه های دنیا معتبر و قابل ترجمه می باشد.
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
instagram.com/ogenetech
مهارت شما آینده شماست
توضیحات
کارگاه SDS-PAGE و وسترن بلات
تکنیک SDS-PAGE
تکنیک SDS-PAGE یک روش کم هزینه سریع و تکرار پذیر جهت مطالعه پروتئین ها می باشد. این روش به طور معمول برای بررسی ماحل خالص سازی، محاسبه مقدار نسبی و تعیین وزن مولکولی پروتئین ها بکار می رود. در تکنیک SDS-PAGE به دلیل استفاده از ماده سدیم دودسیل سولفات (SDS)و همچنین ویژگی های عالی ژل پلی اکریل آمید قدرت تفکیک پروتئین ها بسیار خوب می باشد. SDS یک دترجنت آنیونی می باشد که با اتصال به نواحی هیدروفوب پروتئین ها آنها را دناتوره می کند.
در واقع مولکول SDS با اتصال به پروتئین ها بار طبیعی آنها را می پوشاند و توزیع یکنواختی از بارهای منفی بر روی آن ایجاد می نماید. در نتیجه این اتفاق، جداسازی پروتئین ها تنها بر اساس وزن مولکولیشان صورت می گیرد. جهت خطی نمودن مولکول های پروتئینی، آنها را در مقدار کافی SDS ، و ماده احیا کننده مرکاپتو اتانول جهت از بین بردن باندهای دی سولفیدی و نیز دقایقی حرارت قرار می دهند. مقدار SDS لازم جهت اتصال به پروتئین ها، 1.4 گرم SDS به ازای هر گرم پروتئین می باشد.
حالا در هنگام ران نمودن الکتروفورز جداسازی پروتئین ها تنها بر اساس وزن مولکولی شان خواهد بود. بدین معنا که هرچه اندازه مولکول بزرگتر باشد، حرکت آن به دلیل اصطکاک با محیط اطراف کمتر خواهد بود.
معمولا مولکول SDS به قندها متصل نمی گردد، از این رو پروتئین هایی که بخش قندی آنها بزرگ است، نسبت به وزن مولکولی خود SDS کمتری می گیرند. با کاهش اتصال مولکول های SDS در آنها، حرکت کندتری بر روی ژل خواهند داشت. این امر موجب تخمین وزن آنها بیش از وزن طبیعیشان میشود. جهت حل این مشکل، میتوان SDS-PAGE را در ژل های دارای شیب غلظتی یا در سیستم های بافری تریس- بورات- SDTA به جای بافر معمول تریس –گلیسین قرار داد. بورات با اتصال به قندها، موجب افزایش میزان بار منفی گلیکوپروتئین خواهد شد و تا حدود زیادی کاهش اتصال به SDS جبران خواهد شد.
اثر ژل پلی اکریل آمید
ژل پلی اکریل آمید نقش بسیار موثری در تفکیک پروتئین ها در SDS-PAGE دارا می باشد. قطر منافذ موجود در ژل پلی اکریل آمید که متاثر از غلظت دو جزء سازنده آن می باشد (C % , T %) دامنه وزنی قابل تفکیک در SDS-PAGE را مشخص می کند. به عنوان مثال در ژل با غلظت 5، 10 و یا 15 ٪ (با فرض C معادل 2.6 درصد) به ترتیب می توان پروتئین های در محدوده 20-300 ، 15-200 و 12-100 کیلو دالتون را جدا نمود. باید در نظر گرفت که رابطه مسافت طی شده و لگاریتم وزن مولکولی در محدوده کمی به صورت خطی می باشد. به منظور افزایش میزان این رابطه خطی، باید الکتروفورز را در شیبی از غلظت ژل پلی اکریل آمید انجام داد.
تکنیک SDS-PAGE در شرایط احیایی و غیراحیایی
پیوندهای دی سولفیدی درون رنجیره ای یا بین زنجیره ای نقش عمده ای در شکل گیری ساختمان سوم و چهارم پروتئین ها دارند. احیای این پیوندها با استفاده از مواد تیول دار (مانند 2- مرکاپتو اتانول) منجر به از بین رفتن ساختمان های سوم و چهارم پروتئین ها خواهد شد. پروتئین های دارای پیوند دی سولفیدی ، دارای حرکت متفاوتی در شرایط احیایی و غیر احیایی الکتروفورز می باشند.
احیا شدن این پیوندهای دی سولفیدی موجب جدا شدن زیرواحدهای پروتئینی در پروتئین های چند زیر واحدی و همچنین خطی شدن کلیه پروتئین ها می شود که این امر موجب اتصال یکنواخت SDS به پروتئین خواهد شد. بنا براین میتواند با مقایسه الگوی الکتروفورز احیایی و غیر احیایی یک پروتئین اطلاعات زیادی راجع به ساختار سوم آن بدست آورد. DTT و 2- مرکاپتو اتانول رایج ترین احیا کننده های پیوند دی سولفیدی می باشند.
سیستم بافری SDS PAGE
ژل پلی اکریل آمید از دو قسمت ژل متراکم کننده (Stacking gel) و ژل جداکننده (resolving gel) تشکیل شده است. ژل متراکم کننده در بالا قرار گرفته است و مواد تشکیل دهنده آن با ژل جدا کننده متفاوت می باشد. در ژل متراکم کننده به دلیل تراکم یکسان بار الکتریکی کلیه پروتئین ها حرکت آنها با سرعت یکسانی می باشد و به صورت یک لایه نازک در می آیند. اما با رسیدن مجموعه پروتئینی به ابتدای ژل جدا کننده ، جداسازی آنها بر اساس وزن مولکولی شروع می شود. بار خالص پروتئین- SDS در دامنه PH بین 7-10 تغییر چندانی نمی کند و حرکت پروتئین ها در این دامنه نیز تفاوت محسوسی ندارد.
بافر تریس-گلیسین پر استفاده ترین سیستم بافری ناپیوسته در SDS-PAGE می باشد. در سیستم بافری ناپیوسته ترکیب یونی ، PH بافر در نمونه، ژل و مخازن با یکدیگر متفاوت می باشد. درسیستم بافری ناپیوسته حتی ژل نیز غالبا شامل دو قسمت (ژل بالا و ژل پایین) می باشد. در سیستم بافری ناپیوسته کارایی الکتروفورز خیلی وابسته به حجم نمونه نمی باشد.
در سیستم بافری پیوسته غلظت و ترکیب یون ها و PH در سراسر مسیر الکتروفورز یکسان می باشد.
سیستم بافری لاملی متداولترین سیستم بافری ناپیوسته در الکتروفورز می باشد. در این سیستم نمونه پروتئین و و ژل بالا حاوی بافر تریس- هیدروکلرید با PH=6.8 و ژل پایین حاوی بافر تریس هیدروکلرید با PH=8.8 و بافر مخازن (بافر الکترودها) شامل تریس-گلیسین با PH=8.3 می باشد.
آماده سازی نمونه در SDS PAGE
برای آماده سازی نمونه در SDS-PAGE بافر نمونه را با نسبت خاصی به نمونه می افزایند ، سپس برای دقایقی در آب جوش قرار می دهند. در این شرایط پروتئین ها به واسطه اثر SDS و ماده احیا کننده (در حالت الکتروفورز احیایی) کاملا دناتوره می شوند. میزان SDS در بافر نمونه باید بارها بیشتر از میزان پروتئین باشد (میزان 3 به 1) تا کاملا از اشباع شدن پروتئین با SDDS اطمینان حاصل شود.
وجود گلیسرول یا ساکارز در بافر نمونه باعث سنگین شدن نمونه و قرار گرفتن آن در ته چاهک می شود. این موضوع خصوصا زمانی اهمیت بالایی پیدا می کند که مدت زمان نمونه گذاری زیاد طول بکشد.
در SDS-PAGE معمولا بعد از افزودن بافر نمونه به پروتئین و قبل از نمونه گذاری ، مخلوط آنها را دقایقی (15 -20 دقیقه بسته به نوع پروتئین) در آب جوش قرار می دهند. حرارت موجب جداشدن زیرواحدهای پروتئینهای چند زیرواحدی و تسهیل اشباع شدن زنجیرهای پلی پپتیدی با استفاده از SDS می شود. بعلاوه، این کار موجب غیر فعال شدن بسیاری از پروتئیازها شده و امکان تجزیه پروتئین ها توسط آنها را از بین خواهد برد. اما با این وجود بسیار از پروتئیازها در این شرایط سالم باقی می مانند و لازم است مهار کننده پروتئیاز به نمونه ها افزوده شود.
بعضی پروتئین ها تحت تاثیر SDS تنها، رفتاری مشابه با حالت تحت تاثیر SDS و حرارت دارند ولی بعضی پروتئین ها در هر حالت رفتار متفاوتی از خود بروز می دهند.
مواد لازم جهت انجام SDS-PAGE
- محلول استوک اکریل آمید (30.8 درصد): 30 گرم آکریل آمید و 0.8 گرم بیس اکریل آمید را زیر هود وزن کنید و در آب مقطر تا حجم نهایی 100 میلی لیتر حل نمایید. محلول را با کاغذ واتمن شماره 1 صاف کنید و در ظرف تیره بریزید. این محلول تا 3 ماه در یخچال قابل استفاده است.
نکته: از استنشاق پودر اکریل آمید و بیس اکریل آمید در هنگام توزین و تماس با محلول آنها خودداری نمایید.
- بافر ژل پایین:18.2 گرم تریس باز و 0.4 گرم SDS را در 70 میلی لیتر آب مقطر حل نمایید. PH محلول را با اسید کلریدریک 2 مولار به 8.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 1.5 مولار است.
- بافر ژل بالا:6.1 گرم تریس باز و 0.4 گرم SDS را در 50 میلی لیتر آب مقطر حل نمایید. با اسید کلریدریک 2 مولار PH آن را به 6.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 0.5 مولار است.
- بافر الکترود (بافر مخازن):3 گرم تریس باز، 14.4 گرم گلیسین و 1 گرم SDS را در 1 لیتر آب مقطر حل کنید، PH این بافر حدود 8.3 می باشد و نیاز به تنظیم ندارد.
- بافر نمونه (5X): 10 میلی لیتر بافر ژل بالا، 5 میلی لیتر گلیسرول، 1 گرم SDS، 0.2 میلی لیتر محلول بروموفنلبلو (0.5 درصد در اتانول) و 1 میلی لیتر 2-مرکاپتواتانول را در یک ظرف مخلوط نمایید. سپس با آب مقطر به حجم نمایی 20 میلی لیتر برسانید.
- پرسولفات آمونیوم 10 درصد: 1/0 گرم پرسولفات آمونیوم در 1 میلی لیتر آب مقطر حل کنید. این محلول باید تازه تهیه شود.
- TEMED 10 درصد:1/0 میلی لیتر TEMED در 9/0 میلی لیتر آب مقطر حل کنید. این محلول باید به صورت تازه تهیه شود.
- مارکرهای وزن مولکولی نیز آماده باشند
انجام آزمایش SDS PAGE
- ابتدا قبل از انجام هر گونه آزمایش، پلیت ها، اسپیسرها و شانه ها را در یک دترجنت آزمایشگاهی شسته. دقت شود که از مواد خورنده جهت شستوشو استفاده نشود. در صورتی که ژل برای مراحل بعد مانند رنگ آمیزی با نقره مورد نیاز باشد، توصیه می شود که شیشه ها را به صورت شبانه در کرومیک اسید انکوبه نمایید و سپس با آب مقطر شسته و در نهایت با اتانول ، استون و اتانول به ترتیب شستوشو دهید. هیچگاه اجازه ندهید کرومیک اسید و یا حلال های آلی با ترکیبات پلاستیکی تماس داشته باشند. در نهایت شیشه ها را با دستان پوشیده شده با دستکش تمیز بردارید.
- سر هم کردن پلیت ها:
برای سر هم نمودن ابتدا شیشه مستطیل شکل را روی یک سطح کاملا صاف قرا دهید، سپس اسپیسرها را مطابق شکل روی آن قرار دهید (در مدلهای جدید اسپیسر به شیشه مستطیل چسبیده است و نیاز به قرار دادن آن روی شیشه ندارید)، سپس شیشه U-شکل را روی آن قرار دهید. در این مرحله دقت شود که هر دو شیشه روی هم به صورت کاملا تراز قرار دارند.
- حالا شیشه های روی هم قرار گرفته را مطابق شکل زیر در دستگاه قرار داده. برای این کار تنها لازم است پیچ های دو طرف دستگاه را شل نمایید و شیشه ها را در آن قرار دهید. برای شیشه های سمت دیگر دستگاه نیز همین کار را تکرار نمایید.
- جهت تراز نمودن کامل مطابق شکل زیر با نوک انگشت بررسی شود که آیا شیشه ها کاملا به هم تراز هستند یا نه. در صورت تراز بودن شیشه ها با هم پیچ های دو طرف دستگاه را بسته تا شیشه ها جابجا نشوند. جهت اطمینان از عدم نشت دهی دستگاه، یک قطره کوچک وازلین در ته دستگاه به دو طرف شیشه ها (کنار اسپیرها) بزنید.
- حالا دستگاه را برداشته ومطابق شکل زیر روی تخته ژل قرار دهید و پیچ های تخته ژل را مطابق علامت روی آن سفت کنید. برای اطمینان از بسته شدن درست دستگاه، نشتی آن را با آب مقطر تست کنید.
ریختن ژل پایین (ژل جدا کننده) در SDS PAGE
محلول ژل پایین را از اجزای آن با توجه به درصد آن تهیه نمایید. نحوه تهیه 12 میلی لیتر از محلول ژل پایین در جدول زیر آمده است.
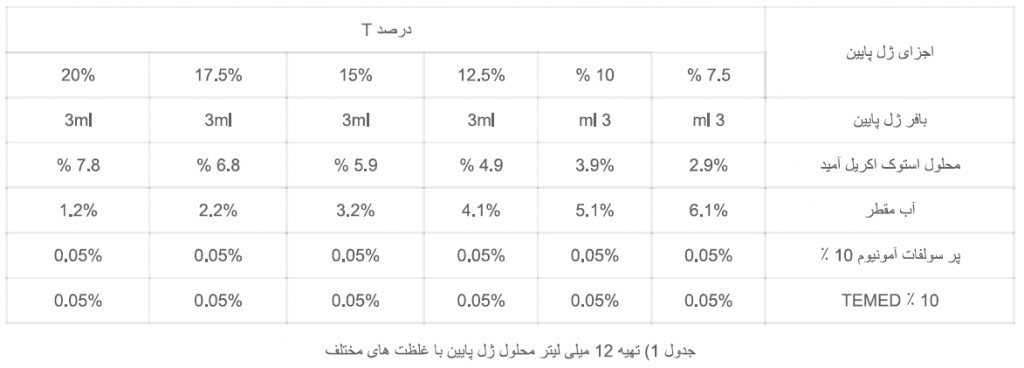
اجزای ژل پایین به غیر از TEMED را در یک ظرف مناسب مخلوط نمایید. محلول را حدود 30 ثانیه با پمپ خلا از هوا تخلیه کنید. سپس TEMED را اضافه کنید. پس از هم زدن سریع ، محلول را در بین شیشه ها تا ارتفاع مناسب بریزید. باید دقت شود که حدود 3 سانتیمتر فضا برای ژل بالا لازم می باشد. حدود 0.5 میلی لیتر آب مقطر با سمپلر به آرامی از کنار شیشه روی سطح ژل بریزید، به نحوی که با ژل مخلوط نگردد. انعقاد ژل پایین معمولا 15-45 دقیقه طول می کشد. ژل منعقد شده به وضوح از آب مقطر روی آن (به دلیل تفاوت در ظریب شکست نور) قابل تشخیص می باشد.
تهیه ژل بالا (ژل متراکم کننده) SDS PAGE
بعد از انعقاد ژل پایین، مطابق جدول زیر ژل بالا را تهیه نمایید.
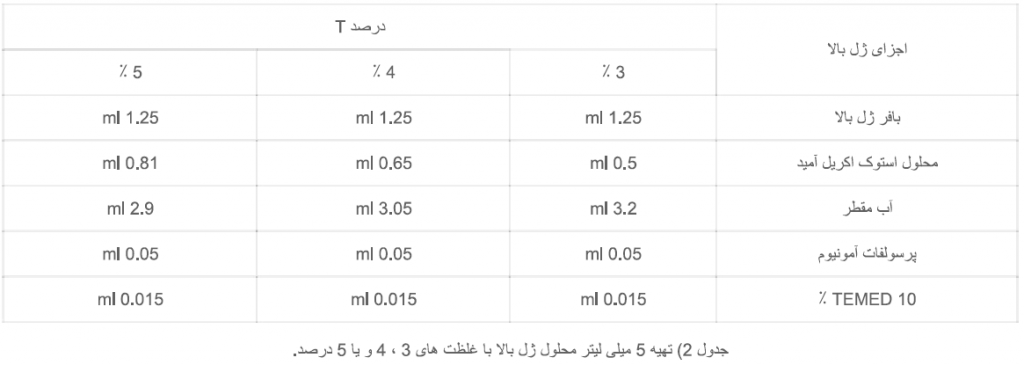
معمولا غلظت این ژل 3، 4 و یا 5 ٪ است. اجزای ژل بالا غیر از TEMED را در ظرف مناسبی مخلوط کنید. آب روی ژل پایین را کاملا خالی کنید. برای حذف قطرات باقیمانده آب، حدود 1 میلی لیتر محلول ژل بالا را در جدار داخلی شیشه بگردانید و مجددا تخلیه نمایید. به بقیه محلول ژل بالا TEMED اضافه نمایید و پس از هم زدن سریعا تا ارتفاع مناسب روی ژل پایین بریزید سپس شانه را با دقت در ژل بالا فرو کنید، به طوری که دندانه های آن حدود 1.5 سانتیمتر از سطح ژل فاصله داشته باشند. معمولا ژل بالا در کمتر از 15 دقیقه می بندد (کناره دندانه های شانه از ژل منعقد شده قابل تشخیص است). بهتر است قبل از دو آوردن شانه ، انتهای دندانه آن را روی شیشه با ماژیک مشخص کنید تا نمونه گذاری و تشخیص چاهک ها راحت باشد.
آماده سازی جهت ران SDS PAGE
پس از بسته شدن ژل بالا، شانه ها را از آن خارج نموده و دستگاه را به دورن تانک قرار دهید. مخازن تانک و دستگاه را تا ارتفاع مناسب به ترتیب با بافر الکترود و بافر نمونه پر کنید. هر گونه حباب در انتهای ژل را با تزریق بافر توسط سرنگ خارج نمایید.
افزودن نمونه ها:
یک حجم بافر نمونه (5 X) را به 4 حجم نمونه پروتئین اضافه نمایید. اگر پروتئین به صورت پودر است، مقدار مورد نیاز آن را در بافر نمونه که 5 بار با آب مقطر رقیق شده (بافر 1 X) ، حل کنید. نمونه و بافر نمونه را در یک ظرف کوچک درب دار ریخته و به مدت 5 دقیقه در ظرف آب جوش قرار دهید. در صورت کدورت نمونه و یا وجود ذرات نامحلول، آن را به مدت 10 دقیقه در دور 10/000 g. سانتریفیوژ نمایید.سپس با سرنگ هامیلتون یا سمپلر مناسب 10-20 میکرولیتر از هر نمونه را به دقت در چاهک بریزید. به دلیل وجود گلیسرول، نمونه در ته چاهک قرار میگیرد. مقدار پروتئین موجود در هر چاهک به میزان خلوص نمونه و روش رنگ آمیزی بستگی دارد.
حالا سیم های رابط را به الکتروفورز وصل نمایید و برای الکتروفورز در جریان الکتریکی ثابت، شدت جریان 20-30 میلی آمپر را تنظیم نمایید. در این حالت رنگ نشانگر (بروموفنل بلو) طی مدت 1.5 تا 2 ساعت به انتهای ژل می رسد.
پس از اتمام عمل الکتروفورز، جریان را قطع نمایید و دستگاه را از تانک بیرون آورید. سپس پیچ های آن را شل نمایید و شیشه های حاوی ژل را با دقت بردارید. با استفاده از کاردک همراه دستگاه به آرامی شیشه ها را از هم جدا کنید و ژل را برداشته. در صورت لزوم ژل را رنگ آمیزی کنید.
رنگ آمیزی
رنگ آمیزی پروتئین ها در ژل پلی اکریل آمید با روش های متنوعی امکان پذیر است. کوماسی بلو (انواع R و G)و نقره از پر استفاده ترین مواد برای رنگ آمیزی پروتئین ها هستند. در اینجا رنگ آمیزی با کماسی بلو که بسیار متداول می باشد ، توضیح داده می شود.
رنگ آمیزی با کوماسی بلو R-250
کوماسی بلو R-250 معمولترین رنگ برای رنگ آمیزی پروتئین ها است. سادگی رنگ آمیزی، هزینه کم، ثبات رنگ برای مدت طولانی و حساسیت نسبتا بالا از مزایای آن می باشند. حساسیت این روش 0.5-0.2 میکروگرم پروتئین در هر باند می باشد. در این روش مراحل تثبیت و رنگ آمیزی پروتئین ها به طور همزمان صورت می گیرد.
شکل 5) حمام رنگ جهت رنگ آمیزی پروتئین ها در ژل اکریل آمید.
مواد
- محلول رنگ آمیزی: 0.25 گرم کوماسب بلو R-250 را در 125 میلی لیتر متانول حل کنید. سپس 25 میلی لیتر اسید استیک گلاسیال و 100 میلی لیتر آب مقطر اضافه نمایید. غلظت رنگ در این محلول حدود 0.1 درصد وزنی/حجمی است. قبل از استفاده محلول رنگ را با کاغذ واتمن شماره 1 صاف کنید. این محلول می تواند به عنوان تثبیت کننده پروتئین ها نیز عمل کند.
- محلول رنگ بر: 200 میلیلیتر متانول، 100 میلی لیتر اسید استیک گلاسیال و 700 میلی لیتر آب مقطر را به هم بیفزایید.
روش رنگ آمیزی
- ژل را در ظرف درب دار قرار دهید. حجم کافی از محلول رنگ (مثلا 100 میلی لیتر برای یک ژل کوچک) اضافه کنید. در ظرف را بسته و آن ربا 1-2 ساعت روی شیکر قرار دهید. این مدت زمان برای رنگ آمیزی ژلی با غلظت 10 ٪ و ضخامت پ میلی لیتر کافی است.
- محلول رنگ را تخلیه کنید. ژل را کاملا با آب معمولی شسته، سپس محلول رنگ بر اضافه کنید. در ظرف را بسته، آن را روی شیکر قرار دهید. پس از تیره شدن محلول رنگ بر، آن را با محلول تازه تعویض کنید. این عمل را چند بار تکرار کنید تا زمینه ژل شفاف گردد و باندهای پروتئینی به وضوح مشاهده شوند.
- ژل را در محلول 7 درصد اسید استیک قرار دهیدو در ظرف را ببنیدید. ژل در این حالت برای مدت طولانی قابل نگهداری است.
تعیین وزن
در تکنیک SDS-PAGE مولکولهای پروتئینی با استفاده از سدیم دودسیل سولفات به صورت خطی در می آیند و حرکت آنها بر اساس وزن میباشد. همانگونه که پیش تر نیز ذکر شد، مسافت طی شده پروتئین ها با لگاریتم وزن مولکولی آنها رابطه خطی دارد. پس هرچه پروتئین بزرگتر باشد مسافت طی شده کمتر خواهد بود.
به طور معمول در زمان بارگیری نمونه ها، در یکی از چاهک ها مارکر پروتئینی نیز اضافه می کنند. مارکرهای پروتئینی متشکل از چندین پپتید با وزن مولکولی مشخص می باشند. با مقایسه نمودن میزان حرکت پروتئین مورد نظر بر روی ژل با مارکر های پروتئینی با استفاده از رسم نمودار حرکت نسبی می توان وزن مولکول هدف را تخمین زد.
الکتروفورز:
به سبب اینکه ماکرومولکول های زیستی مانند DNA و پروتئین ها باردار هستند میتوان با قرار دادن آنها در یک میدان الکتریکی، آنها را بر اساس خواص فیزیکی مانند شکل فضایی، وزن مولکولی و بار الکتریکی، تفکیک کرد. برای این منظور از روشی بنام الکتروفورز استفاده میشود. روش های مختلف الکتروفورزی برای تفکیک و مطالعه بیومولکول ها اعم از اسید های نوکلئیک یا پروتئین ها ابداع شده است.
ژل الکتروفورز:
از یک محیط نیمه جامد (ژل) به عنوان فاز ثابت استفاده میشود. این نوع الکتروفورز برحسب نوع ژل به کار گرفته شده به دو نوع الکتروفورز ژل پلیاکریل آمید (PAGE) و الکتروفورز ژل آگارز تقسیم میشود. الکتروفورز PAGE دارای قدرت تفکیک بسیار بالائی بوده و برای تفکیک پروتئین ها و اسید های نوکلئیک به کار گرفته میشود. به منظور بررسی پروتئین ها با استفاده از PAGE، به سبب اینکه پروتئین ها دارای بارهای متفاوت هستند، معمولاً برای اینکه تفکیک فقط براساس وزن مولکولی انجام شود به بافر ماده شیمیائی SDS (سدیم دو دسیل سولفات ) اضافه میشود. SDS مولکول بزرگی با بار منفی میباشد. این ماده باعث واسرشت شدن پروتئین ها شده و به آنها متصل میشود. به ازای هر دو اسید آمینه، یک مولکول SDS به پروتئین متصل میشود که باعث القاء بارمنفی متناسب با وزن مولکولی به پروتئین میشود. هر چه غلظت پلی اکریل آمید بیشتر باشد قدرت تفکیک ژل بیشتر خواهد بود و مولکول های دارای وزن مولکولی نزدیک به هم را بهتر تفکیک مینماید. برای تفکیک اسیدهای نوکلئیک در صورت امکان از ژل آگارز استفاده میشود. تهیه ژل مزبور به مراتب سریعتر وآسانتر از ژل پلی اکریل آمید بوده و هزینه کمتری را در بر میگیرد.
معمولاً برای تفکیک قطعات بزرگ DNA (بزرگتر از 500 جفت باز) در صورتیکه هدف صرفاً بررسی کیفی و تفکیک باشد استفاده از ژل آگارز انتخاب اول است. برای تفکیک قطعات کوچک DNA دو رشتهای و قطعات DNA تک رشتهای از ژل پلی اکریل آمید استفاده میشود. قدرت تفکیک ژل های مزبور ارتباط مستقیمی با غلظت آنها دارد. برای مثال، برای تفکیک قطعاتی به اندازه 100 جفت باز از آگارز 3% و برای قطعات حدود 2000 جفت باز از آگارز 8/0 % استفاده میشود. در صورتیکه نیاز به تفکیک DNA به صورت تک رشتهای باشد، از مواد واسرشت کننده نظیر اوره، فرمالدهید یا فرمامید در ژل همزمان با الکتروفورز استفاده میشود. به این نوع ژل ها، ژل واسرشت کننده میگویند. چنین ژل هائی پیچ و تاب های اسید های نوکلئیک را از هم باز کرده و بنابراین تفکیک مولکول ها فقط براساس طول و نه ساختار دوم انجام میشود. در این ژل ها مولکول های کوچکتر در مقایسه با مولکول های بزرگتر سریعتر حرکت کرده و مسافت بیشتری را طی میکنند. از روش PAGE برای بررسی جهشها و تعیین توالی DNA استفاده میشود.
محلولها و بافرهای مورد نیاز برای الکتروفورز آگارز
1- آگارز
2- محلول TAE
TAE x 50 :
محلول EDTA (8= PH و M 5/0)
دی سدیم 2H2O . EDTA (Panreac) 1/186 گرم
NaOH (MERCK) حدود 20 گرم
مقدار g242 از Tris-base و ml1/57 از Glacial Acetic Acid را در ml800 آب مقطر حل کرده و مقدار ml100 EDTA M5/0 با PH معادل 8 به آن اضافه می کنیم . سپس حجم محلول را با استفاده از آب مقطر به 1 لیتر می رسانیم .
3 – بافر بارگذاری
0.05% w/v برموفنل بلو
50% (v/v) گلیسرول
EDTA 0.05 %
مواد ذکر شده به اندازهای به آب مقطر اضافه میشوند که غلظت نهایی آنها در محلول به میزان ذکر شده باشد. محلول حاصل در دمای 4 درجه سانتیگراد نگهداری شود.
4- محلول اتیدیوم بروماید mg/ml10
اتیدیوم بروماید (MERCK)10 میلیگرم
آب مقطر 1 میلیلیتر
10 میلیگرم در یک میلیلیتر آب مقطر حل شد و برای چند ساعت روی همزن مغناطیسی و زیر هود شیمیایی قرار داده شد تا کاملاً حل شود محلول انیدیوم در ظرف تیره و دور از نور در دمای اتاق نگهداری شود.
وسایل مورد نیاز
1- دستگاه تولید کننده نور ماوراءبنفش
2 -تانک الکتروفورز ـ پلیت- شانه ژل (Life Technologies)
3- تامین کننده جریان الکتریسیته
روش کار
جهت تهیه مثلاً آگارز 2% ، برای حجم 40 سی سی، مقدار 8/0 گرم پودر آگارز را در ارلن حاوی40 سی سی بافر TAE 1Xمی ریزیم. سپس ارلن حاوی این مواد درون مایکروویو تا مرز جوشیدن حرارت داده میشود (حدود 2 دقیقه) تا این مجموعه با هم ترکیب گردند. در نتیجه حرارت، واحدهای تکرار شونده در آگارز از حالت حلقوی نامنظم به شکل مولکولهای مارپیچ دوتایی درمی آیند و یک شبکه از منافذ با قطر 80 الی 250 نانومتر تولید میکنند. غلظت بالاتر آگارز منافذ ریزتری را ایجاد میکند. وقتی این مجموعه قدری خنک شد (C º40) در حالت مایع به آن 5/1 ـ 1 میکرولیتر اتیدیوم بروماید اضافه میشود. ما باید باندی ببینیم که نشان دهنده انجام PCR می باشد. باید توجه داشت که سطح قالب کاملاً تراز باشد. قطر ژل تا 5 میلیمتر کافی میباشد. درون قالب با استفاده از شانههای پلاستیکی حفراتی ایجاد میکنیم.
ژل را همراه با قالب آن در تانک الکتروفورز، که حاوی 1xTAE است، میگذاریم تا این که محلول کاملاً سطح آنرا بپوشاند. دستگاه مولد برق را به تانک الکتروفورز متصل میکنیم. در این حالت بایستی توجه داشت که جهت حرکت از قطب منفی به مثبت باشد. سپس دستگاه را روشن نموده و بر روی ولتاژ 100 – 50 ولت تنظیم نموده و صبر میکنیم تا رنگ بروموفنل بلو یک سوم طول ژل را طی نماید. ژل را از تانک خارج و آنرا با استفاده از نور UV بررسی مینماییم.
تذکر: بایستی توجه داشت که اتیدیوم بروماید یک ماده جهشزا بوده و تماس آن با پوست و حتی استنشاق بخارات آن خطرناک میباشد.
Polyacrylamide Gel Electrophoresis
الکتروفورز با ژل پلی آکریل آمید
این ژل از پلیمرهای آکریلامید ساخته میشود که بیس آکریلامید به صورت نوارهای عرضی این پلیمر را به طور منظم به هم ارتباط میدهد طوری که منافذ با قطر معین و یکسان در ژل ایجاد میشود پلیمریزاسیون ژل با اضافه کردن آمونیوم پرسولفات (یا ریبوفلاوین) شروع میشود و با افزودن TEMED (یا DMAPN ) تسریع میشود.
TEMED = N,N,N’,N’–tetramethyethylenediamine
DMAPN=3-dimethylamino-propionitrile
TEMED موجب تشکیل رادیکال های آزاد از پرسلفات آمونیوم میشود و این رادیکالها پلیمریزاسیون را باعث میشوند چون باز آزاد موجود در TEMED برای این پروسه ضروری است لذا در pH پایین پلیمریزاسیون است و یا کاملا متوقف میشود .
افزایش TEMED (یا APS) سرعت پلیمریزاسیون را افزایش میدهد.
محلولهای لازم در الکتروفورز ژل پلی آکریل آمید
1ـ آکریل آمید 30%: برای تهیه 100 میلیلیتر از این محلول، gr 29 از پودر آکریل آمید را با gr1 از پودر بیسآکریل آمید مخلوط کرده و حجم آنرا با آب مقطر به 100 میلیلیتر میرسانیم.
2ـ TBE5X : برای تهیه 1000 میلیلیتر از این محلول ،gr54 از پودر Tris را با gr5/27 بوریک اسید مخلوط کرده و 20 میلیلیتر M)EDTA5/0( به آن اضافه میکنیم و با آب مقطر حجم محلول را به 1000 میلیلیتر میرسانیم.
3ـ آمونیوم پرسولفات 10%: برای تهیه 10 میلیلیتر از این محلول، gr1 از پودر APS را با آب مقطر به حجم 10 میلیلیتر میرسانیم. این محلول را بایستی در یخچال و در دمای C º 4 نگهداری کرد.
4ـ TEMED بصورت آماده وجود دارد که این محلول بسیار بد بو و جهشزا میباشد. بنابراین هنگام استفاده بایستی زیر هود کار شود و خیلی سریع کار انجام گیرد
5- بافر لود با حاوی فرم آمید : ml 10فرم آمید ، μl200 EDTA M5/0 با PH 8 ، mg15 گزیلن سیانول و mg3 برومو فینول بلو را مخلوط می کنیم .
وسایل لازم برای الکتروفورز :
1ـ تانک
2ـ شیشههای ساخت ژل
3ـ شانههای مخصوص برای ایجاد چاهکهایی در ژل
4ـ گیره برای نگهداری شیشههای ژل
5ـ Spacer
طرز تهیه ژل :
ژل 8-5% برای PAGE مناسب است و ما در پژوهش خود از ژل 8% استفاده کردیم که برای ساختن آن در حجم cc 32 بصورت زیر عمل کردیم.
در این روش ابتدا شیشه های مورد استفاده جهت تهیه ژل عمودی را با آب مقطر به خوبی شستشو داده و با استفاده از الکل به خوبی تمیز می کنیم . سپس شیشه ها را به شکل عمودی به هم متصل کرده و آنها را برای تهیه ژل آماده می کنیم . سپس محلول آکریل آمید 8% را مطابق زیر تهیه می کنیم:
ml15/13 آب مقطر ( ddH2O ) و ml25/6 محلول آکریل آمید ( 30% ) ، μl350 محلول APS ( آمونیوم پرسولفات ) 10% و ml 5 محلول TBE یا Tris-base Boric acid EDTA x 5 را با هم مخلوط کرده سپس به ml5 از این محلول مقدار μl5 Temed اضافه می کنیم.
سپس محلول فوق را بین شیشه ها ریخته و از آن جهت پرکردن شکافهای موجود بین فاصله دهنده هاSpacer) ) استفاده می کنیم . سپس به بقیه محلول مقدار 10 میکرولیتر Temed اضافه کرده و آنرا بین شیشه ها می ریزیم و شانه را درون ژل قرار می دهیم . باید دقت داشته باشیم که حباب هوا درون ژل وجود نداشته باشد . پس از بستن ژل شانه و فاصله دهنده پایین را به دقت از درون آن خارج می کنیم و شیشه حاوی ژل را با استفاده از گیره روی تانک محکم می کنیم باید توجه داشته باشیم که در قسمت پایین تانک و در زیر شیشه حباب هوا وجود نداشته باشد . از TBE x 1 به عنوان بافر استفاده می کنیم . قبل از لود کردن چاله های بدست آمده را با استفاده از سرنگ به خوبی شستشو می دهیم . سپس محصول هضم آنزیم را درون چاله های بدست آمده می ریزیم . در این مرحله مقدار μl5 از Loading buffer حاوی فرم آمید را به μl10 از هر یک از محصولات PCR هضم آنزیمی اضافه می کنیم . پس از مخلوط کردن بافر با محتویات هرتیوپ را درون هر چاله لود می کنیم .
پس از ریختن نمونه به داخل چاله های ژل آنرا به مدت 5/3 ساعت با ولتاژ 200 الکتروفوز می کنیم.
نتیجه حاصل از هضم آنزیمی به شکل دو باند که مربوط به SMN1 و SMN2 به ترتیب با اندازه های 188و 149 قابل مشاهده می باشد که بر روی این باندها آنالیز دانسیتومتری انجام می گیرد.
رنگ آمیزی نیترات نقره
اولین مرحله پس از اتمام الکتروفورز خارج کردن ژل از میان شیشه ها است برای این کار با استفاده از کارد پهن بین دو شیشه فاصله ایجاد می کنیم و آنها را از هم جدا می کنیم . سپس ژل را درون ظرف رنگ آمیزی قرار می دهیم . جهت ثابت کردن DNA بر روی ژل ابتدا ml250 محلول اسید الکل ( محلول A ) را داخل ظرف ریخته و به مدت 3 دقیقه به آرامی تکان می دهیم سپس محلول قبلی را دور ریخته و دوباره عمل شستشو با اسید الکل را تکرار می کنیم .
جهت رنگ آمیزی ژل از محلول نیترات نقره 1/0% ( محلول B ) استفاده می کنیم . پس از خارج کردن محلول قبلی به آرامی مقدار ml250 از محلول فوق را داخل ظرف ریخته و آنرا به مدت 15 دقیقه تکان می دهیم . ( Shaking )
در مرحله بعدی محلول B را به آرامی خارج کرده و ژل را با آب مقطر شستشو می دهیم . سپس مقدار ml250 محلول C را اضافه کرده و تا ظاهر شدن بندها ( حدود 15 دقیقه ) آنرا به آرامی تکان می دهیم .
محلولهای مورد نیاز جهت رنگ آمیزی نیترات نقره :
محلول A : این محلول شامل 10% اتانول و 5/0% اسید استیک است . جهت تهیه ml500 از این محلول مقدار ml50 الکل 100% را با مقدار ml 5/2 اسید استیک مخلوط کرده و حجم محلول را بهml500 می رسانیم .
محلول B : این محلول حاوی 1/0% نیترات نقره می باشد که محلول غلیظ آن بصورت x10 تهیه شده و در شیشه قهوه ای رنگ قابل نگهداری است . این محلول با حل کردن mg1 نیترات نقره درml100 آب مقطر تهیه می شود . جهت تهیه محلول مورد نظر مقدار ml25 از این محلول را به حجم ml250 می رسانیم .
محلول C : این محلول حاوی 5/1% NaOH و 15/0% Formaldehyde می باشد . برای تهیه ml250 از این محلول مقدار g75/3 از NaOH را در مقداری آب مقطر حل کرده و حجم آنرا به ml249 میرسانیم ، از آنجائیکه فرمالدئید مورد استفاده 37% می باشد برای بدست آوردن درصد مورد نظر مقدارml1/1 از آنرا به محلول فوق اضافه می کنیم .


















نقد و بررسیها
هنوز بررسیای ثبت نشده است.