09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
آموزشگاه آزاد نانو زیست فناوری اوژن اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
دوره جامع ارشد مهندسی ژنتیک ( کلونینگ) و دوره جامع کشت سلول
سرفصل مطالب
- مبانی مهندسی ژن
- آشنایی با انواع وکتورها
- آموزش ساخت محیط کشت، تکثیر و ذخیره سازی باکتری
- تکثیر پلازمید
- تخلیص پلازمید
- هضم آنزیمی
- لیگاسیون
- تهیه باکتری مستعد (competent cell)
- ترانسفورماسیون (انتقال وکتور به درون سلول)
- جداسازی و گزینش کلون ها
- تکثیر کلونها در سلول میزبان
- استخراج از ژل و clean up
- ساخت آگارز
- الکتروفورز
- آنالیز داده ها
- ظرفیت محدود
- همراه با ارائه مدرک معتبر
ویژگی های آموزشگاه نانو زیست فناوری اوژن (تکوین)
- تمام دوره ها و کارگاه ها با ظرفیت محدود (نهایتا ۴ تا ۵ نفر) برگزار می گردد.
- تمام تکنیک های عملی توسط خود کارآموز بعد از آموزش کامل انجام می شود.
- در پایان دوره های آموزشگاه اوژن می توانید در آزمون فنی و حرفه ای شرکت کرده و مدرک فنی و حرفه ای دریافت نمایید، که به علت قید ساعت آموزشی برای شما به منزله ی کارآموزی یا کارورزی بوده و در تمام دانشگاه های دنیا معتبر و قابل ترجمه می باشد.
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
instagram.com/ogenetech
مهارت شما آینده شماست
توضیحات
دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
کلونینگ چیست ؟
به فرآیندی اطلاق میشود که طی آن مولکولهای DNA نوترکیب تولید و به یک ارگانیسم میزبان انتقال داده شده و در آنجا تکثیر مییابند. کلونینگ بصورت کلی یعنی به معنای ایجاد کپیهای یکسان از محصول مورد نظر است.
یک فرایند کلونینگ مولکولی معمولاً شامل دو جزء اصلی زیر میباشد:
- قطعه DNA مورد نظر
- وکتور/ پلاسمید که شامل اجزاء لازم برای تکثیر در ارگانیسم میزبان است.
ژن مورد نظر (ژن هدف) میتواند یک ژن، عناصر تنظیمکننده یا اپرون، یک پروموتر یا هر قطعه دیگری باشد. که آن را میتوان با روشهای مختلفی برای کلون کردن آماده کرد. DNA مورد نظر را میتوان با استفاده از آنزیمهای محدودکننده از یک منبعِ DNAی دیگر مانند وکتور/ پلاسمید یا DNA ژنومی برش زد. با استفاده از واکنش زنجیرهای پلیمراز (PCR)، قطعه DNAی مورد نظر را میتوان تکثیر کرد. قطعه DNA مورد نظر را میتوان با به هم چسباندن اولیگونوکلئوتیدهای تک رشتهای مونتاژ کرد.
پلاسمید (پلازمید) یک قطعه کوچک و حلقوی از DNA است که در داخل سلول میزبان مجزا از DNA کروموزومی یا ژنومی تکثیر مییابد. اغلب پلاسمیدهای رایج مورد استفاده در تکنولوژیِ DNA نوترکیب، به منظور مطالعه و دستکاری ژنها بهینه شدهاند. به عنوان مثال بیشتر پلاسمیدها در باکتری E. coli تکثیر میشوند و دارای اندازهی نسبتاً کوچک (∼ 3000 تا 6000 جفت باز) می باشند که برای دستکاری آسان میباشند. فرآیند کلونینگ مولکولی به دانشمندان این امکان را میدهد تا کروموزومها و ژنها را مورد مطالعه قرار دهند.
امروزه دانشمندان میتوانند ژنها و سایر عناصر ژنتیکی را به راحتی با استفاده از پلاسمیدهایی که بطور خاص مهندسی شدهاند، مورد مطالعه و دستکاری قرار دهند و به این ترتیب پلاسمیدها تبدیل به ابزارهای قدرتمندی در ژنتیک مولکولی شدهاند.
کاربرد کلونینگ :
- به دست آوردن توالی یک ژن خاص
- آنالیز توالی DNA
- بررسی عملکرد یک آنزیم،RNA یا پروتئین
- بررسی جهش موجود در یک ژن
تکنیک ها
- مبانی مهندسی ژن:
بهعنوان بخشی از دانش زیست فناوری؛ به مجموعه روشهایی گفته میشود که به منظور جداسازی، خالصسازی، وارد کردن و بیان یک ژن خاص در یک میزبان بکار میروند و نهایتاً منجر به بروز یک صفت خاص یا تولید محصول مورد نظر در جاندار میزبان میشود. کاربردهای مهندسی ژنتیک تقریباً نامحدود به نظر میرسد. این علم کاربردهای زیادی در علوم پایه، داروسازی، علوم دامی، تولیدات دامی، کشاورزی و علوم پزشکی دارد. در زمینه علوم پایه، بررسیهایی مانند مکانیسمهای همانندسازی DNA و بیان ژنها در پروکاریوت ها، یوکاریوت ها و ویروس ها و همچنین چگونگی ساخته شدن و تغییرات پروتئینهای داخلی سلول و همچنین سازوکار ایجاد سرطان از جمله کاربردهای مهندسی ژنتیک است.
- آشنایی با انواع وکتورها:
پلاسمید “Plasmid vector“
کاسمید “Cosmid“
باکتریوفاژ “Bacteriophage vector“
کروموزوم مصنوعی باکتریایی “Bacterial artificial chromosome“
کروموزوم مصنوعی مخمر “Yeast artificial chromosome
کروموزوم مصنوعی انسان “Human artificial chromosome“
ناقلان ویروسی، حیوانی و گیاهی “Animal and plant viral vectors“
- آموزش ساخت محیط کشت، تکثیر و ذخیره سازی باکتری
محیط کشت باکتری باید به گونهای تهیه شود که قبل از تلقیح با یک باکتری خاص، استریل باشد تا تنها نوع باکتری موجود در نمونه باشد. محیط کشت باید هر آنچه باکتری برای تکثیر نیاز دارد را فراهم کند، بنابراین دما، اسیدیته، نوع بستر، مواد غذایی و اکسیژن اهمیت دارند. تعداد محیط موجود برای رشد باکتری قابل توجه است. برخی از محیطهای کشت عمومی از رشد طیف وسیعی از ارگانیسم ها پشتیبانی میکنند. یک نمونه برجسته از یک محیط همه منظوره، آبگوشت سویا آزمایشگاهی (TSB) است.
از محیطهای تخصصی در شناسایی باکتریها استفاده میشود و با رنگها، شاخصهای PH یا آنتی بیوتیک ها تکمیل میشود. یک نوع ماده غنی شده شامل فاکتورهای رشد، ویتامین ها و سایر مواد مغذی ضروری برای رشد ارگانیسمهای سریعالرشد است، ارگانیسمهایی که نمیتوانند مواد مغذی خاصی ایجاد کنند و نیاز به افزودن آنها به محیط دارند.
- تکثیر پلازمید
از پلازمیدها در مهندسی ژنتیک برای تکثیر یا بیان ژن یا ژنهای خاصی استفاده میشود. برای این کار، ژن مورد نظر را وارد پلازمید میکنند. این نوع از پلازمیدها بهطور معمول دارای یک ژن مقاومت آنتیبیوتیکی (برای غربالگری) و یک جایگاه کلونینگ چندگانه (به انگلیسی: multiple cloning site ) یا polylinker است.
- تخلیص پلازمید
خالص سازی پلازمید تکنیکی است که به منظور جداسازی و خالص نمودن DNA پلازمیدی از DNA ژنومی ،پروتئین ها،ریبوزوم ها ، و دیواره سلولی باکتریایی به کار میرود . پلاسمید ،DNA دو رشته ای ، حلقوی ، کوچک میباشد که به عنوان حامل برای مولکول های DNA خاص به کار می رود. زمانی که از طریق ترانسفورمیشن به یک ارگانیسم میزبان عرضه میشود، یک پلازمید همانندسازی خواهد کرد، و نسخه های متعدد از قطعه DNA تحت مطالعه به وجود می آیند.
- هضم آنزیمی
آنزیم های محدودکننده توالی خاصی از DNA دو رشته ای را برش میزنند. تکنیک زیر می تواند مورد استفاده قرار گیرد تا هر قطعه DNA به راحتی منتقل شود، این تکنیک درحالتی کاربرد دارد که محل برش آنزیم ها در دو طرف ژن مورد نظر بوده و مکمل آنها را بتوان در محل مناسبی از وکتور ایجاد کرد تا بتوان ژن را به درون پلازمید منتقل کرد.
آنزیم های محدودکننده (اندونوکلئازهای محدودکننده) پروتئین هایی هستند که DNA را در (یا نزدیک به) مکان های شناسایی خاص برش میزنند. دو نوع آنزیم محدود کننده وجود دارد که در نحوه قطع DNA هدف متفاوت عمل میکنند:
- برش با ایجاد انتهای بلانت: این آنزیم های محدودکننده هر دو رشته DNA هدف را در یک نقطه بریده و انتهای صاف ایجاد می کنند.
- برش با ایجاد انتهای چسبنده: این آنزیم های محدودکننده هر دو رشته DNA هدف را در نقاط مختلف برش می دهند و 3′- یا 5′- آزاد و 1 تا 4 نوکلئوتید (به اصطلاح انتهای چسبنده) ایجاد می کنند.
- لیگاسیون
لیگاسیون به معنای بستن رگها به روش جراحی از طریق یک برش کوچک در پوست میباشد تا از جمع شدن خون در رگ جلوگیری به عمل آید. عمل جراحی لیگاسیون ممکن است همراه با عمل استریپینگ یا برش و برداشتن اعمال شود.
- تهیه باکتری مستعد (competent cell)
مستعد کردن از مراحل مهم کلونینگ است و باید با دقت لازم انجام شود که برای وارد کردن توالی خارجی به داخل سلول میزبانش استفاده میشود.
- ترانسفورماسیون (انتقال وکتور به درون سلول)
انتقال افقی ژن (به انگلیسی: Horizontal gene transfer، به طور مخفف HGT) که به نام (به انگلیسی: Lateral gene transfer، به طور مخفف LGT) هم شناخته میشود، به انتقال ماده ژنتیکی میان جانداران در مسیری غیر از انتقال عمودی ژنها (به انگلیسی: vertical transfer) میگویند. در انتقال عمودی ژنها، ماده ژنتیکی از والد به فرزندان انتقال پیدا میکند. انتقال افقی ژنها یکی از مهمترین عوامل مقاومت آنتیبیوتیکی در باکتریها است. از انتقال افقی ژنها در مهندسی ژنتیک نیز استفاده میشود. برای مثال باکتریهای تجزیه کننده سموم کشنده آفات گیاهی. چند سازوکار مختلف برای انتقال افقی ژنها وجود دارد:
- ترانسفورماسیون (به انگلیسی: Transformation): سلول، ماده ژنتیکی بیگانه (DNA یا RNA) را برداشته (وارد خود میسازد) و آن را بیان میکند. این پدیده بیشتر در باکتریها دیده شدهاست و کمتر در یوکاریوتها مشاهده میشود. در آزمایشگاههای ژنتیک، از ترانسفورماسیون برای ورود ژنهای جدید به داخل باکتری جهت مصارف صنعتی یا بیوتکنولوژی استفاده میگردد.
- ترانسداکشن (به انگلیسی: Transduction): فرایندی است که در آن، DNAی باکتریایی از یک باکتری به باکتری دیگر از طریق فاژ (باکتریوفاژ) منتقل میشود.
- هم یوغی یا کونژوگاسیون (به انگلیسی: conjugation): فرایندی است که ماده ژنتیکی از طریق تماس مستقیم دو باکتری با هم صورت میگیرد. در این فرایند، باکتری نر با استفاده از پیلی جنسی به باکتری ماده میچسبد و سپس ماده ژنتیکی مربوطه را به باکتری ماده منتقل میکند.
ترانسفورماسیون گیاهان مستلزم داشتن بافت گیاهی سالم با رشد و تقسیم سریع میباشد.
- جداسازی و گزینش کلون ها
تولید هرچه بیشتر متابولیت های ثانویه توسط سلول های کشت شده حاصل از القاء کالوس از اهمیت خاصی برخوردار است. اخیرا با استفاده از روش های گزینش کلون توانسته اند نژادهای سلولی که مقادیر بیشتری آلکالوئید نسبت به سلول های گیاه طبیعی تولید می کنند را جداسازی نمایند. به دلیل هتروژن بودن سلول های گیاهی کشت شده، گزینش موفق سلول های تولید کننده مقادیر زیاد متابولیت ثانویه امکان پذیر گردیده است.
- تکثیر کلونها در سلول میزبان
کلونینگ مولکولی به فرآیندی اطلاق میشود که توسط آن مولکولهای نوترکیب DNA تولید، به یک ارگانیسم میزبان انتقال داده شده، و در آنجا تکثیر مییابند. یک واکنش کلونینگ مولکولی معمولاً شامل بر دو جزء اصلی زیر میباشد:
۱- قطعه DNA مورد نظر یا اینسرت ( Insertیا DNA fragment of interest)؛
۲- وکتور/ پلاسمید که شامل تمام اجزاء لازم برای تکثیر در ارگانیسم میزبان است.
- استخراج از ژل و clean up
از کیت استخراج از ژل و تخلیص محصول PCR ، میتوانید جهت تخلیص قطعات DNA از ژل آگارز ( با پایه TAE و یا TBE) و یا محصول PCR و یا دیگر واکنش های آنزیمی استفاده کنید. این کیت قادر به خالص سازی قطعات از 65bp تا 10kbp میباشد. همچنین این کیت توانایی ریکاوری 70 تا 85 درصد از ژل آگارز و 90 تا 95 درصد از محصول PCR را دارد.
- ساخت آگارز
روش آماده سازی ژل آگارز برای الکتروفورز از بافر و پودر آگارز استفاده می شود. نسبت این دو بستگی مستقیمی به سایز و شکل DNA یا مولکول هایی که قرار است الکتروفورز شوند دارند. برای تهیه ژل آگارز ، معمولا پودر آگارز را در یک بافر مناسب حل می کنند؛ از جمله بافرهایی که برای این کار استفاده می شوند TAE و TBE را می توان نام برد. بافر TAE از تریس ، استیک اسید و EDTA تشکیل شده است و برای تنظیم اسیدیته محیط به کار می رودو غلظت آن در ژل و تانک الکتروفورز باید یکسان باشد تا حین برقراری جریان الکتریکی، تعادل یونی بین ژل و بافر تانک ایجاد شده و اختلالی در حرکت نمونه های DNA رخ ندهد. در بافر TBE به جای استیک اسید از اسید بوریک استفاده می شود. بافر TAE دارای کمترین ظرفیت بافری می باشد اما قدرت تفکیک آن برای مولکول های بزرگ DNA بسیار خوب می باشد. معمولا بافرهایی که حاوی EDTA هستند، جهت غیر فعالسازی انواع نوکلئازهایی که نیازمند کاتیون های دوظرفیتی جهت فعالیت خود می باشند، روش آماده سازی ژل آگارز برای الکتروفورز استفاده می کنند
الکتروکوچ یا الکتروفورز (به انگلیسی: Electrophoresis) به حرکات ذرات در یک مایع تحت میدان الکتریکی گویند. الکتروکوچ از شناخته شدهترین روشهای آزمایشگاهی برای جداسازی بیومولکولها است.
به سبب اینکه ماکرومولکول های زیستی مانند DNA و پروتئین ها باردار هستند میتوان با قرار دادن آنها در یک میدان الکتریکی، آنها را بر اساس خواص فیزیکی مانند شکل فضایی، وزن مولکولی و بارالکتریکی، تفکیک کرد. برای این منظور از روشی بنام الکتروکوچ استفاده میشود. روشهای مختلف الکتروکوچی برای تفکیک و مطالعه بیومولکول ها اعم از اسیدهای نوکلئیک یا پروتئینها ابداع شدهاست.
بهطورکلی الکتروکوچ حرکت ذرات پراکنده در داخل مایعی تحت تأثیر یک میدان الکتریکی یکنواخت است. همین حرکت در فضایی با میدان الکتریکی غیریکنواخت دیالکتروکوچ نامیده میشود. الکتروکوچ تکنیکی است که برای جداسازی و در برخی مواقع خالصسازی ماکرومولکولها بهویژه پروتئینها و اسیدهای آمینه که در اندازه، بار و ترکیب متفاوتند، به کار میرود. زمانیکه مولکولهای بارگذاری شده در یک میدان الکتریکی قرار میگیرند، بر اساس بار الکتریکیشان به سمت قطب مثبت (آند) یا منفی (کاتد) حرکت میکنند. سرعت حرکت مولکولها در این شرایط نه تنها تحت تأثیر بار الکتریکی و شدت میدان الکتریکی است، بلکه عواملی نظیر اندازه، وزن مولکولی و شکل فضایی مولکول نیز در این امر دخیل هستند.
- آنالیز داده ها
تحلیل داده فرایند فهمیدن، پاک سازی، آمادهسازی و تحلیل دادههاست که به منظور استخراج اطلاعات سودمند برای تصمیم گیری انجام میشود. منظور از تحلیل داده به فرایند ارزیابی داده با استفاده از ابزارهای آماری و تحلیلی است. هدف از این مهارت تعیین اطلاعات مفید و همچنین کمک به فرایند گرفتن تصمیمات مهم در کسبوکار است.
7 مرحله ی اساسی کلونینگ یک ژن :
- جدا سازی قطعه ژن مورد نظر جهت کلونینگ
- وارد کردن ژن مورد نظر به داخل یک وکتور مناسب جهت ایجاد (recombinant DNA)
- وارد کردن recombinant DNA به داخل یک ارگانیسم مناسب ( میزبان )
- انتخاب سلولهای میزبان ترنسفورم شده و شناسایی کلونهای حاوی ژن مورد نظر
- تکثیر/بیان ژن هدف در سلول میزبان
- جداسازی کپیهای ژنی تکثیر یافته/ پروتئینهای بیان شده از ژن هدف
- خالص سازی و جداسازی قطعات ژنی/ پروتئینی
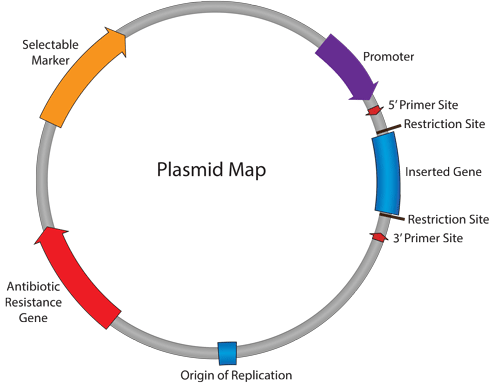
اجزای ضروری در کلونینگ وکتور
همهی وکتورهای کلونینگ DNA باید دارای یکسری خصوصیت مشترک باشند:
- باید توانایی همانندسازی بصورت خودمختار در درون میزبان داشته باشند.
- دارای جایگاه برش انحصاری برای آنزیمهای محدودکننده باشد.
- قطعه DNA ی insert شده نباید در خصوصیات همانندسازی وکتور تداخل ایجاد کند.
- باید دارای تعدادی marker gene جهت آنالیزهای بعدی باشد تا بتوان از این ژنهای مارکر برای شناسایی سلولهای recombinantاستفاده کرد ( معمولا ژنهای مقاوم به آنتی بیوتیکی که در سلول میزبان وجود ندارد).
به راحتی از سلول میزبان قابل جداسازی باشند.
۸ نکته مهم برای داشتن یک کلونینگ مولکولی موفق
۱- زمان کافی برای طراحی آزمایشهای خود اختصاص دهید
توجه به جزئیات هنگام طراحی و برنامهریزی برای یک پروژه کلونینگ ضروری است. با درک کاملی از روشهای مورد استفاده و توالیهای تولید شده، اطمینان حاصل کنید که طراحی شما صحیح و دقیق است. به اتصال توالیها و اثر آن بر روی چارچوب خوانش (Open reading frame; ORF) هر توالیِ کدکننده توجه کنید. به جایگاههای شناسایی آنزیمهای محدودکننده (Restriction site of restriction enzyme)، هم در وکتور و هم در DNA مورد نظر (Insert)، قبل از طراحی پرایمرهای PCR (که حاوی سایتهای شناسایی مشابه با آنچه در کلونینگ استفاده میشوند، هستند) دقت کنید. مطمئن شوید که نشانگر انتخابی آنتیبیوتیکی (Antibiotic selective marker ) در وکتور، با نژاد میزبان انتخابی سازگار باشد. پیشنهاد میشود قبل از شروع کار در آزمایشگاه، مراحل انجام پروژه کلونینگ خود را در نرم افزارهای آنلاین و یا آفلاین مخصوص این کار، شبیهسازی کنید.
۲- با یک DNA تمیز و در غلظت مناسب شروع کنید
اطمینان از اینکه منبع DNA شما عاری از آلایندهها، از جمله نوکلئازها و فعالیتهای آنزیمی ناخواسته است، مهم میباشد. استفاده از کیتهای مبتنی بر ستون مانند کیتهای استخراج از محصول PCR، و استخراج از ژل ستونی برای خالصسازی DNA، روش خوب و مناسبی است. قبل از دستکاری DNA، تمام حلالها از جمله فنل، کلروفرم و اتانول را کاملاً حذف کنید. اطمینان حاصل کنید که شستشوی نهایی و خروج DNA از ستونها، با بافر عاری از نمک انجام شده باشد. به این ترتیب مانع از مهار مراحل پایین دست مانند برش با آنزیمهای محدودکننده و یا تکثیر با PCR میشوید. برای تکنیک مورد استفاده در پروژه کلونینگ خود مقدار کافی از DNA وارد واکنش کنید. بمنظور برش با آنزیمهای محدودکننده، اغلب بین 2/0 تا 2 مایکروگرم نیاز است، در حالیکه تنها مقادیر بسیار کمی (در حد نانوگرم) از DNAی الگو برای انجام PCR کافی است.
۳- برش با آنزیمهای محدودکننده را با دقت انجام دهید
مهم است که هنگام برش DNA، واکنش هضم با آنزیم را به درستی تنظیم کنید. حجم واکنش باید با مرحله پایین دست، سازگار باشد به عنوان مثال باید کمتر از حجم چاهک ژل آگارز ِمورد استفاده برای جدا کردن قطعات DNA باشد. اغلب حجم یک واکنش کلونینگ کلاسیک، بین 20 تا 50 مایکرولیتر است. حجم آنزیم (های) محدودکننده اضافه شده نباید بیش از 10٪ از حجم کل واکنش باشد، تا اطمینان حاصل شود که غلظت گلیسرول زیر 5٪ در واکنش باقی میماند. این نکته برای به حداقل رساندن فعالیت ناخواسته و غیر اختصاصی آنزیمهای محدود کننده (Star activity) مهم و ضروری است.
۴- به انتهاهای ایجاد شده توجه کنید
با فرض اینکه انتهاهای ایجاد شده برای اتصال سازگار باشند، یعنی دارای انتهای چسبندهی (Overhang یا Sticky end) مکمل یا انتهای صاف (Blunt end) باشند، DNAی مورد نظر و وکتور بدون اصلاحِ بیشتر برای کلونینگ آماده هستند. اما اگر انتهاهای آنها سازگار نباشند، باید با استفاده از روشهای مناسب اصلاح شوند (به عنوان مثال از blunting reagents، فسفاتازها و غیره استفاده شود).
اگر برای آمادهسازی انتهاهای DNA، از PCR و DNAپلیمرازِ Taq (Taq DNA Polymerase) استفاده میشود، یک نوکلئوتید آدنین (A) اضافی در انتهای 3 پرایم آن باقی میماند. استفاده از DNAپلیمرازهای High-fidelity (High-fidelity DNA polymerases)، انتهای صاف ایجاد میکند. انجام PCR، با استفاده از پرایمرهای تجاری استاندارد، قطعات غیرفسفریله تولید میکند، مگر اینکه پرایمرها در انتهای 5 پرایم خود فسفریله باشند. محصول PCR ممکن است قبل از اتصال به یک وکتور دفسفریله، نیاز داشته باشد تا با یک آنزیم کیناز (مانند T4 Polynucleotide Kinase; T4 PNK) تیمار شود تا یک گروه فسفات در انتهای 5 پرایم آن اضافه گردد.
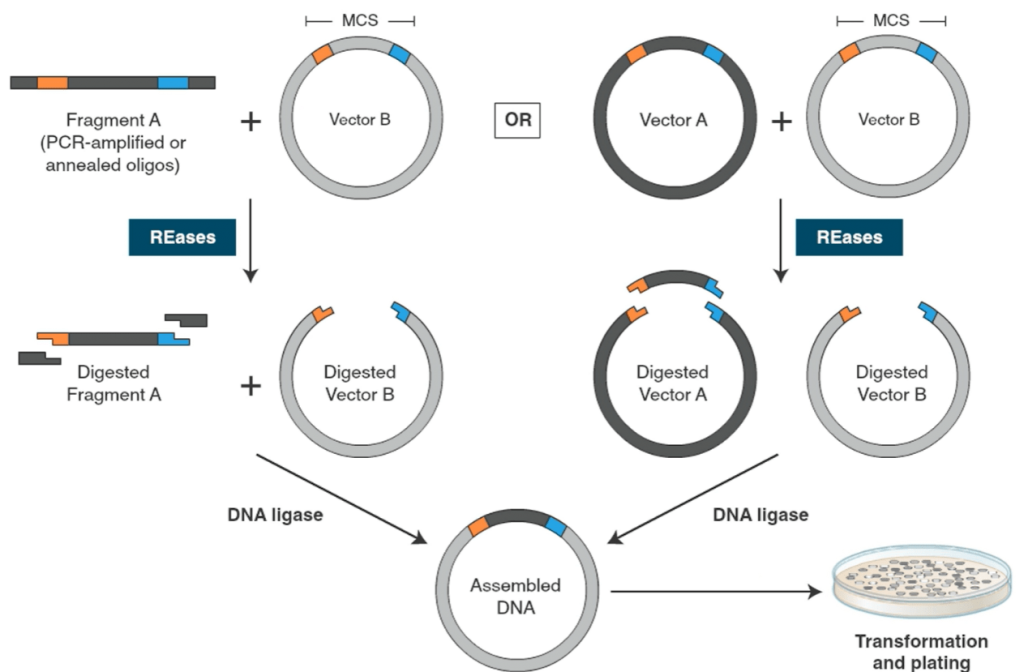
۵- قبل از اتصال وکتور به DNA مورد نظر، هر دو جزء را تمیز کنید
استفاده از کیتهای استخراج محصول PCR (یا PCR & DNA Cleanup Kit)، در مواردی که قطعه DNA مورد نظر توسط PCR تکثیر مییابد، میتواند نتایج کلونینگ شما را به طرز چشمگیری بهبود بخشد. همچنین استفاده از الکتروفورز ژل آگارز برای جداسازیِ قطعه DNA مورد نظر از سایر قطعات ناخواسته (پس از هضم با آنزیم) متداول است. در این روش قطعه DNA مورد نظر در زیر نور UV از روی ژل برش زده میشود و در نهایت با استفاده از کیت استخراج ژل قابل بازیابی است. استفاده از طول موج بلند (365 نانومتر) برای به حداقل رساندن هرگونه آسیب DNA ناشی از اشعه ماوراء بنفش پیشنهاد میگردد.
۶- مقادیر قطعات (DNA) خود را اندازه گیری کنید
با روشهای ساده سنجش کمی مانند الکتروفورز ژل با استانداردهای مشخص (Gel electrophoresis with mass standards) یا طیف سنجی با استفاده از اسپکتروفتومترهای با ورودی کم (مانند نانودراپ)، از مناسب بودن مقادیر مواد برای انجام واکنش اتصال (Ligation reaction) اطمینان حاصل کنید.
۷- دستورالعملهای شرکتهای سازنده را برای واکنش اتصال (joining/ligation) دنبال کنید
برای کلونینگ معمولی دستورالعملهای تعیینشده توسط شرکت تهیهکننده لیگاز را دنبال کنید. اگر نسبت مولی 1 به 3 قطعه مورد نظر (Insert) به وکتور توصیه میشود، در ابتدا برای رسیدن به بهترین نتیجه این نسبت را امتحان کنید. استفاده از این نسبت 1 به 3 ثابت نیست و بسته به پیچیدگی پروژه کلونینگ شما میتواند تغییر کند.
سایتهای مختلفی برای محاسبهی نسبت مولیِ قطعه مورد نظر (Insert) به وکتور وجود دارد، که برای نمونه لینک تعدادی از آنها در زیر آورده شده است.
https://nebiocalculator.neb.com/#!/ligation
http://www.insilico.uni-duesseldorf.de/Lig_Input.html
https://worldwide.promega.com/resources/tools/biomath
۸- از سلولهای مستعد (Competent cell) متناسب با نیازهای خود استفاده کنید
اگرچه پروتکلهای زیادی برای مستعدسازی سلول میزبان وجود دارد، ولی استفاده از سلولهای مستعد تجاری میتواند باعث صرفهجویی در وقت و منابع شما شود و کلونینگ شما قابل تکرار خواهد بود.
و …













نقد و بررسیها
هنوز بررسیای ثبت نشده است.