50. کارگاه مهندسی حاملهای دارو رسان
آموزشگاه نانو زیست فناوری اوژن (تکوین)، اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
کارگاه مهندسی حاملهای دارو رسان
سرفصل و محتوا:
- معرفی سیستم های دارو رسانی
- روش های ساخت حامل های دارو و مشخصه یابی آن ها
- روش های تحویل حامل های دارو به بدن
- پاسخ سیستم ایمنی به نانو ذرات و ماندگاری درون تنی و کلانشیم حذف آنها از بدن
- معرفی و بررسی اثر هاله پروتئینی و ارزیابی تشکیل آن
- دارو رسانی هدفمند Targeted delivery
- چالش های طراحی سیستم های دارو رسانی
🔴ظرفیت محدود
🔴قیمت استثنایی
🔴همراه با ارائه گواهی مهارت آموزی از سازمان فنی و حرفه ای کشور
🍁پیشرفت هریک از شما پیشرفت ماست.🍁
❖ ── ✦ ──『✙ – ✙』── ✦ ── ❖
برای اطلاع از جزئیات ثبتنام و مشاوره میتوانید از طریق شمارهتلفن، واتساپ ،اینستاگرام، تلگرام و وبسایت آموزشگاه آزاد ژن فناوری اوژن اقدام کنید.
www.ogene-tech.com
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
@ogenetech
💫«مهارت شما آینده شماست»💫
توضیحات
کارگاه مهندسی حاملهای دارو رسان (Drug Delivery Systems)
سیستم دارو رسانی کنترل شده و اهمیت آن
آنچه پس از شنیدن نام دارو برای اولین بار به ذهن خطور میکند، شاید چیزی فراتر از قرص، کپسول یا آمپول نباشد! در حالیکه دنیای دارو و روشهای انتقال آن به بدن به همینها خلاصه نمیشود. معمولاً داروها به دو طریق گوارشی (ورود از طریق دهان و جذب به سمت خون در طول لوله گوارشی) و غیرگوارشی (تزریق، قطرههای چشمی و…) وارد بدن میشوند. ورود دارو از این روشها مشکلات و محدودیتهایی را به دنبال دارد و به همین دلیل محققان در پی راههایی بودند که بتواند مشکلات فوق را تا حد زیادی حل کند. به دنبال این تلاشها سیستمهای رهایش کنترل شده دارو مطرح شد که دارای مزایای زیادی است. مهمترین این مزایا شامل این موارد است: توانایی حفظ غلظت دارو در حدی نسبتاً ثابت برای مدتی مشخص، قابلیت تنظیم سرعت آزاد شدن دارو و وابسته به محل دارورسانی، امکان رساندن دارو به یک عضو یا بافت خاص، توانایی رساندن چندین ماده دارویی همزمان با یک فرمولاسیون، امکان دارورسانی در ابعاد نانومتری و… این سیستمها انقلابی را در زمینه درمان بسیاری از بیماریها ایجاد نموده و در حال پیشرفت روزافزون است. رهایش کنترل شده دارو فرایندی است که در آن یک حامل پلیمری (مانند: نانوذرات پلیمری، نانوذرات فلزی، نانوذرات پروتئینها، نانوذرات لیپیدی، لیپوزوم و نیوزوم)، سرامیکی یا فلزی بهطور حساب شدهای با دارو یا عامل فعال ترکیب شود تا عامل فعال در بدن به شکلی از پیش تعیین شده و دلخواه از این ماده رها شود.
دارورسانی توسط نانوحاملها
در سالهای اخیر توجه زیادی به استفاده از نانو ذرات به عنوان حاملهای دارویی شدهاست. نانوذرات حاملهای کلوئیدی هستند که میتوانند منشأ طبیعی یا مصنوعی داشته باشند و سایز آنها معمولاً بین ۱ تا ۱۰۰۰ نانومتر میباشد. نانوحاملها ممکن است از مواد پلیمری مثل پلیآمیدوآمین یا مواد معدنی مثل طلا تهیه شده باشند، این ناقلین که به صورت نانو کپسولها و نانواسفرها وجود دارند میتوانند داروهای مختلف را جذب و کپسوله نمایند و بدین وسیله دارو را در مقابل تخریب آنزیمی و شیمیایی محافظت نمایند و به بافت و سلولهای مختلف هدایت کنند. نانو کپسو لها سیستمهای وزیکولی هستند که دارو در حفرههای آن محصور شده و با یک غشاء پلیمری احاطه میشود، در حالی که در نانو اسفرها دارو به صورت فیزیکی و یکنواخت در ماتریس پلیمری پراکنده شدهاست. انواع دیگری از حاملهای کلوئیدی نیز وجود دارند که نانو نیستند مثل لیپوزومها و میسلها که بهطور گسترده برای انتقال دارو به بدن مورد استفاده قرار میگیرند، که البته این حاملها به دلیل ویژگیهای منحصر بفردشان از نانوحاملهای پلیمری و معدنی جدا میشوند. سیستمهای دارورسانی مبتنی بر حاملهای نانویی اکنون به بازار دارویی جهان وارد شدهاند و استفاده از آنها در دارورسانی روز به روز رو به افزایش است. دورنمای آتی تحقیقات بر توسعه نانوذرات دارویی با عملکرد چندگانه مثلاً ذرات با قابلیت دارورسانی هدفمند و همزمان تصویربرداری قرار دارد.
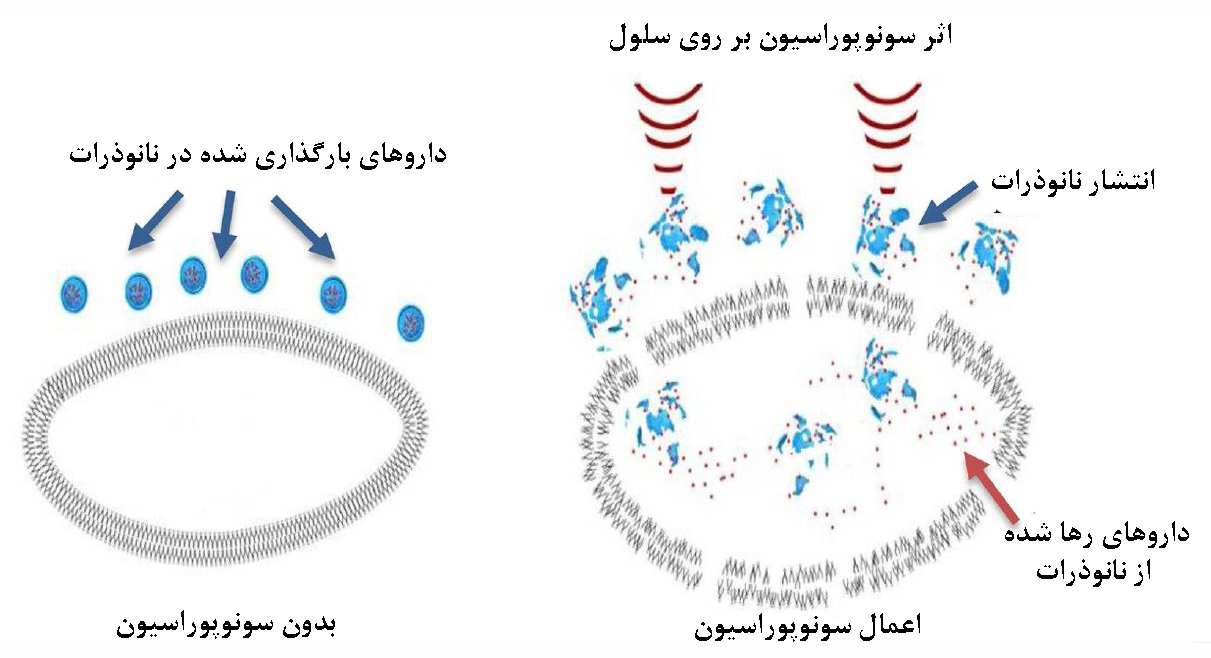
نقش مهندسی بیومتریال در زمینه دارورسانی
همانطورکه در تعریف فوق ارائه شده، بخش عمدهای از این سیستمها شامل موادی است که به عنوان بستر قرارگیری دارو یا محفظهای جهت حبس دارو به کار میروند و نقش بسزایی در روند رها شدن دارو، نرخ رهایش، نوع رهایش، غلظت دارو در بافت یا خون و… در کل هدایت پروسه دارورسانی تحت کنترل مناسب دارد. یک مهندس بیومتریال با کسب دانشهای مناسب از جمله: شناخت مواد مختلف، نوع رفتار مواد و خواص مواد در مواجهه با سیستم بدن، محاسبات ریاضی و مهندسی در زمینه عبور و نفوذ مواد در مواد دیگر و احاطه بر رفتارهای بدن و مسیرهای مختلف و موانع مختلف در عبور دارو در بدن میتواند با انتخاب مادهای مناسب که بتواند تمام انتظارات طراحی را فراهم کند یک سیستم مناسب را طراحی نماید. از طرفی مهندسان بیومتریال این قابلیت را دارند که بتوانند خواص مواد مختلف را مناسب کاربرد مورد نظر تغییر دهند یا اصلاح کنند. امروزه رهایش دارو یکی از زمینههای کاری و تحقیقاتی بسیار وسیع در رشته مهندسی بیومتریال میباشد و حضور و پیشرفت دانشهایی همچون: ژنتیک، نانو تکنولوژی و… نیز در کنار مهندسی بیومتریال زمینههای تحقیقاتی را گسترش داده بهطوریکه شاهد پیشرفتهای چشمگیری نیز بودهایم.
سیستمهای معمول رهایش دارو
سیستمهای معمول رهایش دارو در بدن، عبارتند از قرصها، کپسولها، کرمها، پمادها، محلولها، ذرات معلق (سوسپانسیونها و امولسیونها) و سیستمهای تزریقی که استفاده از آنها با وعدههای متناوب باعث ایجاد نوساناتی در غلظت داروی خون (گاهی بین دو حد سمی و درمانی) میکند که این مشکل علاوه بر مسائلی نظیر درد تزریق و مشکل بلع قرصها توسط برخی از بیماران موجب توجه به روشهای مناسب انتقال دارو شد. سطح درمانی دارو باید در بیمار به اندازهای باشد که تا زمان مصرف بعدی دارو، نیاز بیمار را برآورده کند. اما متأسفانه مشاهده میشود که کاهش یا افزایش بیرویهٔ سطح دارو در بدن، تأثیرگذاری آن را تحت تأثیر قرار میدهد. در حقیقت بعد از وارد شدن ناگهانی دارو به بدن، در این حالات مقدار دارو در سیستم گردش خون یا محل تزریق افزایش مییابد که این امر خود میتواند در بعضی داروهای سمی ایجاد سمیت کند. به این دلیل، تکنولوژیهای رهایش آهسته و کنترل شده دارو با هدف کنترل نرخ رهایش دارو و هدفمند شدن رهایش دارو به سمت یک بافت یا محل خاص مطرح گردید. البته استفاده از این سیستمها محدودیتهایی نیز ایجاد میکند که ممکن است شامل پیدایش مسمومیتهای جدید در اثر بهکار بردن مواد تازه در بدن همراه با داروها، تأخیر در پراکنده شدن دارو و نیاز به آزمایشهای جدید برای بررسی حامل دارویی است.
رهایش دارو به مجموعه عملکردها فرمولاسیونها، تکنیکها و سیستمهایی برای انتقال یک داروی ترکیبی در بدن جهت ایمن کردن اثر درمان استفاده میشود. این ممکن است از نظرعلمی به درون بدن وابسته یا ممکن است از طریق تسهیل در زمینه فارماکوکینتیک سیستمیک عمل کند. در هر صورت، معمولاً مقدار و مدت زمان رهایش دارو و کیفیت رهایش مهم است. رهایش دارو معمولاً از طریق فرمول شیمیایی دارو مطرح میشود، اما ممکن است شامل داروهای پزشکی یا داروهای ترکیبی باشد. رهایش دارو یک مفهوم است که بسته به شدت و میزان دوز و راه نفوذ تعریف میشود. فن آوریهای تحویل دارو پروفایل رهایش دارو، جذب، توزیع و حذف در بهبود کارایی و ایمنی محصول، و همچنین راحتی و رعایت بیمار مؤثر میباشد. رهایش دارو بر اساس فرایند: انتشار، تخریب، تورم، و مکانیسم مبتنی بر افینیته میباشد. شایعترین راههای تجویز این روش دارویی عبارتند از رهایش دردهان (دهان)، موضعی (پوستی)، ترانس موکوسال (بینی، بوکال / زیر جلدی، واژینال، چشم و رکتال) و راههای استنشاقی میباشد. بسیاری از داروها مانند پپتید و پروتئین، آنتیبادی، واکسن و داروهای مبتنی بر ژن بهطور کلی ممکن است با استفاده از این روشها رهایش دارو نداشته باشند؛ زیرا ممکن است حساسیت به تخریب آنزیمی داشته باشند یا به دلیل مسائل مربوط به اندازه مولکولی و شارژ در سطح برای درمان مؤثر باشد به همین دلیل بسیاری از داروهای پروتئین و پپتیدی باید یا به صورت تزریقی یا آرایش نانوذرات رهایش داشته باشند. به عنوان مثال، بسیاری از واکسنها بر اساس رهایش داروهای پروتئین و اغلب با تزریق عمل میکنند. تلاشهای کنونی در زمینه دارورسانی شامل توسعه تحویل هدفمند است که در آن دارو تنها در ناحیه مورد هدف در بدن (به عنوان مثال در بافتهای سرطانی) فعالیت میکند. فرمولاسیون آزاد شدن و پایدار دارو در طول دوره آزمایشی و مدت زمان کنترل شده در طول رهایش دارو به فرمولاسیون و روشهای افزایش باقی ماندن عامل رهایش یافته وابسته است. که در ان باید دارو از محیط اسیدی معده عبور کند. به منظور دستیابی به اهداف مؤثر هدفمند، طراحی سیستم شده باید طوری باشد که از مکانیسمهای دفاعی میزبان دوری کند و به محل مورد نظر برسد. انواع فرمولاسیونهای مناسب در رهایش شامل لیپوزومها، فازهای میکرو تجزیه پذیر مواد دارویی و رهایش دارو بررسی میشود. برخی از عاملها از طریق معده بهطور معمول جذب میشود.انواع فرمولاسیونهای پایدار این مواد شامل لیپوزومها، میکرو فازهای با قابلیت تجزیه مواد دارویی و مواد دارویی پلیمری هستند.
پایداری عاملها در معده انسان بهطور معمول، مسئلهای است که ترکیب و عوامل نمیتوانند در برابر قرص جامد عمل کند. که این یکی از زمینههای تحقیقاتی است که در ان به استفاده ازساختارهای چربی مقاوم به اسید در معده عمل کند.

سیستمهای دارورسانی میکرومقیاس
مفهوم کاربرد ذرات برای انتقال دارو اولین بار با استفاده از داروهای تشخیصی در سیستمهای رتیکواندوتلیال (کبد، طحال، مغز استخوان و غدد لنفی) رواج یافت و موجب گسترش روزافزون سیستمهای میکروذره شد. این ذرات به منظور بهبود دارورسانی وارد فناوری دارویی شدند و توانستند نسبت به سیستمهای رایج دارورسانی، اثرات مفیدی بر کینتیک و فراهمی زیستی دارو نشان دهند. اندازهی این ذرات میتواند بین ۱ تا ۱۰۰۰ میکرومتر باشد.
تمایل به کوچک کردن ذرات، بسیار پیشتر در صنایع دیگر معرفی شده بود اما دلیل اصلی استفاده از این ترکیبات در داروسازی، راه حلهایی بود که با کاهش اندازه ذرات در فناوری انتقال دارو معرفی گردید. افزایش انحلال داروها با کاهش اندازه ذرهای یکی از مهمترین اهداف استفاده از این ذرات به شمار میآید. با وجود این، استفاده از میکروذرات مزایای بسیار دیگری را نیز به همراه دارد. روش تزریقی روشی است که موجب اثر سریع دارو بر بدن میشود چرا که دارو سریعتر وارد جریان خون عمومی بدن که با تمام ارگانها در ارتباط است میگردد. با ورود میکروذرات به حیطهی دارورسانی، امکان استفاده از فرمهای غیر تزریقی نیز رواج بیشتری یافت زیرا انحلال بیشتر مولکولهای دارویی سبب شد که بتوان از آنها در اشکال غیر تزریقی نیز استفاده نمود.
یکی دیگر از ویژگیهایی که با کاهش اندازه ذرهای داروها ایجاد گردید، افزایش ماندگاری آنها در بدن است، زیرا ذرات کمتر در دسترس سیستمهای حذفی بدن نظیر کلیه، کبد و … قرار گرفته و در نتیجه احتمال حذف آنها از بدن کاهش مییابد. به همین دلیل ماندگاری داروها در بدن افزایش یافته و تعداد دفعات مصرف دارو کمتر میشود. با این روش، علاوه بر هزینهی کمتری که بیمار به علت کاهش دفعات مصرف دارو میپردازد، عوارض جانبی دارو نیز کمتر در بیمار بروز مینماید. این رژیمهای مصرفی همراهی بیشتر بیماران را در پی دارد.
طی سالهای متمادی استفاده از میکروذرات بسیار رواج یافت و توانست پیشرفتی ارزنده در زمینهی دارودرمانی ایجاد نماید. اما مواد در مقیاس میکرو اغلب ویژگیهای فیزیکی مشابه با فرم توده و درشت مولکول را نشان میدهند. به علاوه، محققین دریافتند که برای دسترسی بیشتر به سلولها و دارورسانی به آنها، می بایست حامل دارویی نیز در ابعاد خود سلولها و اندامکهای داخلی آنها باشد. در حقیقت محققان به دنبال راهی بودند تا بتوانند در ابعاد خود سلول های بدن وارد سلولها شده و کارایی را افزایش دهند. در نتیجه انتظار میرفت که سیستمهایی موثرتر معرفی گردند که مشهورترین سیستمهای معرفی شده نانوذرات هستند.
سیستمهای دارورسانی نانومقیاس
فناوری نانو به معنای استفاده از مواد، تجهیزات و سیستمهایی در مقیاس نانو است. گرچه این فناوری جزء علوم نوین محسوب میشود اما پیش از این نیز استفاده از نانو ذرات در درمان بیماریها گزارش شده است. به طور مثال، در کتب طب قدیم گزارشهایی مبنی بر استفاده از محلولهای کلوعیدی طلا برای درمان آرتریت به چشم میخورد. آنچه دربارهی فناوری نانو جدید است، همراه شدن توانایی ما برای دیدن و دستکاری ترکیبات در مقیاس نانو و فهم واکنشهای بین مواد و سلولها در مقیاس مولکولی است. نانوذرات به دلیل خواص منحصربفرد خود توانستند ویژگیهایی را ایجاد نمایند که پیش از این در سایر سیستمهای دارورسانی دیده نشده بود.
اندازهی نانوذرات و ویژگیهای آنها در اثرات زیستی
یک مقایسهی ساده بین اندازهی نانوذرات با مواد موجود در بدن وجود دارد. طبیعت در ساخت سیستمهای زیستی از مقیاس نانو استفاده میکند. در نتیجه برای همراهی با طبیعت به منظور درمان بیماریهایی مانند نقص ژن، کشتن باکتریها، کشتن سلولهای سرطانی، ترمیم متابولیسم سلولی یا حتی رفع علائم پیری و مشکلات زیبایی، میبایست از مقیاس مشابه با طبیعت یعنی مقیاسنانو استفاده نمود.
نسبت اندازهی سطح به حجم در نانوذرات در مقایسه با مواد مشابه با اندازهی بزرگتر بسیار افزایش یافته است به این معنا که، تعداد اتمهای موجود در سطح نانوذرات نسبت به ترکیبات توده بیشتر است. همین ویژگی سطحی نانوذرات باعث میشود که برخی خصوصیات فیزیکی مواد ایجاد شده تغییر نماید. به عنوان مثال سرعت انحلال نانوذرات تغییر میکند.
مزایای عمومی نانوذرات
· این ذرات توانایی محافظت از داروی بارگیری شده در برابر عوامل محیطی را دارند.
· افزایش ماندگاری دارو در جریان خون.
· افزایش ورود به بافتها و سلولهای هدف.
· انتقال داروهای کم محلول.
· هدف درمانی به صورت غیرفعال به دلیل تجمع در کبد و طحال و بافتهای سرطانی.
· پیشرفت گسترده در درمان برخی بیماریها نظیر بیماریهای مرتبط با مغز به دلیل بهبود عبور دارو از سد خونی- مغزی.
· افزایش فراهمی زیستی در مصرف خوراکی داروها در مقایسه با راههای پیشین مصرف.
· قابلیت هدفمندسازی نانوذرات.
· کاهش دوز مورد نیاز برای بیمار.
· کاهش کلی هزینههای درمانی بیماران.














نقد و بررسیها
هنوز بررسیای ثبت نشده است.