57. ارزیابی بیان پروتئین نوترکیب
آموزشگاه آزاد نانو زیست فناوری اوژن (تکوین) اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
ارزیابی بیان پروتئین نوترکیب
سرفصل مطالب:
- کشت باکتری
- خالص سازی پروتئین
- انجام الکتروفورز پروتئین
- تایید پروتئین به دست آمده از طریق وسترن بلاتینگ
- ظرفیت محدود
- همراه با ارائه مدرک معتبر
ویژگی های آموزشگاه نانو زیست فناوری اوژن (تکوین)
- تمام دوره ها و کارگاه ها با ظرفیت محدود (نهایتا ۴ تا ۵ نفر) برگزار می گردد.
- تمام تکنیک های عملی توسط خود کارآموز بعد از آموزش کامل انجام می شود.
- در پایان دوره های آموزشگاه اوژن می توانید در آزمون فنی و حرفه ای شرکت کرده و مدرک فنی و حرفه ای دریافت نمایید، که به علت قید ساعت آموزشی برای شما به منزله ی کارآموزی یا کارورزی بوده و در تمام دانشگاه های دنیا معتبر و قابل ترجمه می باشد.
برای اطلاع از جزئیات ثبتنام و مشاوره میتوانید از طریق شمارهتلفن، واتساپ ،اینستاگرام، تلگرام و وبسایت آموزشگاه آزاد نانو زیست فناوری اوژن اقدام کنید.
www.ogene-tech.com
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
@ogenetech
مهارت شما آینده شماست
توضیحات
ارزیابی بیان پروتئین نوترکیب
روش سنتز شیمیایی روش کارآمدی برای تولید مولکول های کوچک است ولی فرآیند پیچیده و هزینه بری می باشد و برای تولید پروتئین های بسیار پیچیده مناسب نیست، بنابراین تولید در مقیاس بالای پروتئین ها عمدتا مستلزم تولید در سیستم های زنده است. از سوی دیگر ایزوله کردن پپتید ها و پروتئین ها از منابع طبیعی فرآیند فشرده و زمان بری می باشد و تولید در مقیاس بالا را با مشکل مواجه می کند. خوشبختانه با ظهور تکنولوژی DNA نوترکیب در سال1970 ابزار مقرون به صرفه ای برای تولید پروتئین ها فراهم گردید. در اوایل 1980 با تایید انسولین نوترکیب تولید شده در E.coli توسط FDA، درهای جدیدی برای تولید سایر داروهای نوترکیب گشوده شد.
برای تولید پروتئین نوترکیب انتخاب میزبان مناسب بسیار مهم است. طیف گسترده ای از میزبان ها برای بیان پروتئین ها در دسترس است. پروتئین ها را می توان در کشت های سلولی باکتریایی، مخمر ، قارچ های رشته ای، حشرات ، پستانداران یا گیاهان تولید کرد. علاوه بر کشت های سلولی تولید پروتئین ها در گیاهان و حیوانات تراریخت نیز امروزه مرسوم است. پروتئین های بزرگ عموما در سیستم های یوکاریوتی و پروتئین های کوچک در سیستم های پروکاریوتی بیان می شوند.
E.coli با توجه به مزایای بسیاری که دارد اولین و گسترده ترین میزبانی است که برای تولید پروتئین های نوترکیب استفاده می شود. تولید پروتئین نوترکیب در E.coli با یکسری چالش ها نیز روبرو است که این چالش ها در رابطه با عدم تولید پروتئین، شکل گیری اینکلوژن بادی، غیر فعال بودن پروتئین های تولید شده و عدم انتشار برخی از مقالات در رابطه با تولید پروتئین نو ترکیب است . با وجود معایبی که در رابطه با E.coli ذکر شد این سیستم همچنان به عنوان سیستم غالب در بیان پروتئین های نوترکیب به کار خود ادامه می دهد چرا که با انجام یکسری استراتژی ها می توان بر این مشکلات غلبه کرد.
از اوایل سال 1900 زمانیکه تنها منابع اصلی دردسترس گیاهان و حیوانات بودند،پروتئین ها به عنوان نهادهای درمانی مهم در نظر گرفته می شدند.با استخراج انسولین از پانکراس خوک در سال 1920، استفاده از پروتئین ها آغاز گردید. با این حال در سال 1970 با ظهور تکنولوژی DNA نوترکیب مشاهده گردید که پروتئین های دارویی نوترکیب می توانند به وسیله ی E.coli با یک روش قدرتمند و مقرون به صرفه تولید شوند. در اوایل 1980 با تایید انسولین نوترکیب تولید شده به وسیله ی E.coli برای درمان دیابت توسط FDA درهای جدیدی را بر روی تولید سایر داروهای نوترکیب گشود. از آن زمان علاوه بر E.coli میزبان های مختلفی مانند مخمر،قارچ های رشته ای سلول های حشرات،سلول های پستانداران و گیاهان و جانوران تراریخت برای تولید داروهای نوترکیب مختلف استفاده می شوند. امروزه بیش از 151 داروی نوترکیب مجزا توسط FDA و EMA برای اندیکاسیون های کلینیکال مختلف تاییدیه گرفته اند که یک سوم از این پروتئین ها در E.coli تولید می شود.
روش های تولید پروتئین
روش سنتز شیمیایی اگرچه روش کارآمدی برای تولید مولکول های کوچک است ولی فرآیند پیچیده و هزینه بری است و برای تولید پروتئین هایی که به اندازه کافی پیچیده هستند مناسب نیست بنابراین تولید در مقیاس بالای پروتئین ها عمدتا مستلزم تولید در سیستم های زنده است. از سوی دیگرایزوله کردن پپتیدها و پروتئین ها از منابع طبیعی فرآیند فشرده و زمان بری می باشد و تولید در مقیاس بالا را با مشکل مواجه می کند.خوشبختانه تکنولوژی DNA نوترکیب ابزار مقرون به صرفه ای را برای تولید پروتئین ها فراهم آورده است پروتئین ها با استفاده از مهندسی پروتئین و مهندسی ژنتیک به صورت تجاری در صنایع تولید می شوند.پروتئین های طبیعی و نوترکیب بخش عمده ای از صنعت زیست دارو، صنعت آنزیم و صنعت کشاورزی را به خود اختصاص می دهند. با استفاده از مهندسی ژنتیک ، پروتئین های مورد نظر در پاسخ به نیازهای صنعت به طور انبوهی تولید شده اند.از اینرو امروزه بیشتر محصولات زیست دارو به روش نوترکیب تولید می شوند . نمودار 1-1 روند رو به رشد فروش زیست داروها را نشان می دهد.
انتخاب میزبان مناسب
برای تولید پروتئین ها انتخاب میزبان نوترکیب مناسب بسیار مهم است. معیارهایی که برای انتخاب میزبان در نظر می گیرند عبارتند از:
- فاکتورهایی که در رابطه با خود پروتئین است شامل: وزن پروتئین، تعداد باندهای دی سولفیدی ، نوع تغییرات پس از ترجمه که باید بر روی پروتئین اعمال شود، مقصد پروتئین بیان شده و کاربرد پروتئین خالص سازی شده
- هزینه تولید و تخلیص
- توانایی کنترل محصول نهایی که شامل فرآیندهای پس از ترجمه است
- زمان لازم که صرف فرآیند از ژن تا پروتئین نهایی می شود
- مسیر قانونی برای تایید یک دارو که بر روی یک سیستم بیانی خاص تولید شده است
- حق امتیاز کلی که در رابطه با تولید محصول نوترکیب در یک پروتئین خاص وجود دارد.
طیف گسترده ای از میزبان ها برای بیان پروتئین ها دردسترس است.پروتئین ها را می توان در کشت های سلولی باکتریایی،مخمر،قارچ های رشته ای،حشرات ، پستانداران یا گیاهان تولید کرد.علاوه بر کشت های سلولی تولید پروتئین ها در گیاهان و حیوانات تراریخت نیز امروزه مرسوم است. پروتئین های بزرگ عموما در سیستم های یوکاریوتی و پروتئین های کوچک در سیستم های پروکاریوتی بیان می شوند.
گیاهان تراریخت
استفاده از گیاهان تراریخت دارای یکسری مزایا می باشد از جمله:
- مقرون به صرفه بودن
- تولید سطح بالایی از پروتئین در گیاهان
- فرآیند اتقال ژن نسبتا آسان
- ایمنی بالا و اندک بودن خطر آلودگی به پاتوژن های حیوانی
- کمتر بودن زمان صرف شده برای رسیدن به محصول نهایی نسبت به کشت سلول های پستانداران و حیوانات تراریخت
- تا خوردن مناسب پروتئین و شکل گیری تغییرات پس از ترجمه
- ذخیره سازی راحت تر نسبت به کشت سلول های حیوانی و حیوانات تراریخت
- نسبتا ساده و ارزان بودن تولید در مقیاس بالا: رشد در مقیاس کشاورزی تنها نیازمند آب ،مواد معدنی و نور خورشید است در حالیکه کشت سلول های حیوانات فرآیند بسیار ظریف و گرانی می باشد و نیازمند بیوراکتورهایی است که برای تولید در مقیاس تجاری باید تا چند صد میلیون برای آنها هزینه شود هزینه شود.
علیرغم آنچه در بالا ذکر شد، تولید پروتئین نوترکیب در گیاهان دارای یک سری معایب می باشد. احتمال آلودگی با آفت کش ها، علف کش ها و متابولیت های گیاهی سمی وجود دارد . همچنین خالص سازی پروتئین ها به علت حضور پروتئاز ها و موادی مانند پلی فنول که به خوبی توسط بیماران تحمل نمی شوند با مشکل مواجه است. بعلاوه اضافه کردن کربوهیدرات ها به زنجیره هیدروکربنی در گیاهان مشابه سلول های حیوانی نیست.پروتئین هایی که در گیاهان ساخته می شوند بجای اسیدسیالیک انتهایی حاوی زایلوز هستند که ممکن است بدن بیمار را وادار به پاسخ ایمنی کنند. یکی از نگرانی های اصلی که در رابطه با تولید پروتئین در گیاهان تراریخت وجود دارد مسائل اخلاقی مربوط به آن است. زمانی که یک گیاه تراریخت در محیط باز کشت داده می شود سبب انتشار غیرقابل کنترل پروتئین ها و در نتیجه آنتی ژن ها می گردد. مقداراندک این آنتی ژن ها ممکن است یک مقاومت کم در انسان القا کنند و یا مانند یک واکسن ناشناخته انسانی عمل کند. این مشکل را نمی توان به آسانی حل کرد . برای حل این معضل راه کارهایی ارائه شده است. راه کار اول شامل نگهداری گیاهان در محیط های استریل مانند گلخانه ها، برای پیشگیری از هرگونه انتشار ترانسژن ها است که البته به طور قابل ملاحظه ای هزینه تولید را افزایش می دهد . راه کار دوم محدود کردن تولید پروتئین های نوترکیب به گیاهانی است که برای انسان استفاده نمی شوند مانند تنباکو و یونجه. علاوه بر دو راه کار گفته شده استفاده از گیاهانی که در مقدار زیاد، باهزینه کم و درمناطق محدود کشت داده می شوند و یا کشت دادن سلول های گیاهی نیز امکان پذیر است. لازم به ذکر است که روند تولید دارو با استفاده از گیاهان ترانس ژن بسیار آرام است.
حیوانات تراریخت
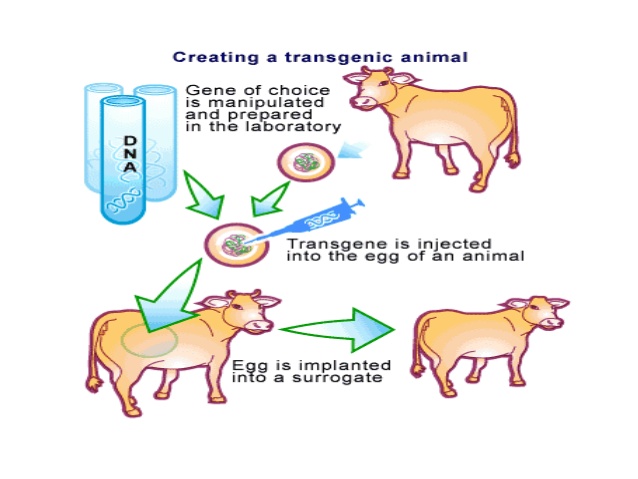
حیوانات تراریخت برای تولید پروتئین های نوترکیب در شیر، سفیده تخم مرغ، خون ، ادرار و پیله ی کرم ابریشم استفاده می شوند.حیوانات تراریختی مانند بز، موش، گاو،خوک،خرگوش،گوسفند و برخی از حیوانات آبزی برای تولید پروتئین های نوترکیب توسعه یافته اند. در حال حاضر عمدتا دو سیستم تولید پروتئین در حیوانات تراریخت استفاده می شود که شامل شیر تراریخت و سفیده تخم مرغ است.به وسیله این دو سیستم پروتئین هایی مانند Human antithrombin III ، هورمون های رشد،فاکتورهای خونی ، فاکتورهای رشد و سایتوکین ها تولید شده اند. مزایای این سیستم عبارت است از:
- میزان پروتئین نوترکیب تولید شده از طریق حیوانات تراریخت بسیار بالاست .بعنوان مثال گاو در روز 30 لیتر شیر تولید می کند که حاوی 35 گرم بر لیتر از پروتئین است و بنابراین تولید کلی پروتئین مورد نظر در روز 1 کیلوگرم است.
- پروتئین تولید شده عمدتا به فرم فعال و طبیعی است
مقرون به صرفه بودن تولید پروتئین در شیر نسبت به تولید با کشت سلولی پستانداران
- تاکنون عوارض جانبی از این محصولات ارائه نشده است.
- مسائل اخلاقی که در رابطه با گیاهان تراریخت وجود داشت در مورد حیوانات تراریخت وجود ندارد چرا که شانس اینکه حیوانات از محیط پرورش خود فرار کنند بسیار پایین است. بعلاوه در اکثر موارد حیوانات از بیان پروتئین خارجی در شیر یا تخم مرغشان رنج نمی برند.
علیرغم مزایای ذکر شده بیان پروتئین نوترکیب در حیوانات تراریخت با چالش هایی روبرو است. از مشکلات این سیستم بیان پروتئین نوترکیب این است که دست یابی به محصول نهایی بسیار طولانی است و هزینه های نگهداری بالا می باشد. بعنوان مثال هزینه نگهداری یک گاو تحت روش های خوب کشاورزی 10000 دلار در سال است.
سلول های پستانداران
کشت سلولی پستانداران معروفترین سیستم ها برای بیان پروتئین های گلیکوزیله هستند. مزایای این سیستم عبارت است از:
- اغلب پروتئین گلایکوزیله تولید شده توسط این سیستم الگوی گلیکوزیلاسیون مشابه انسان دارند.
- پروتئین های تولید شده به درستی تا شده اند و در نتیجه نیاز به رینیچر شدن از فرآیند تولید پروتئین حذف می گردد.
- سلول های یوکاریوتی می توانند برای اضافه کردن زنجیره اسیدهای چرب و فسفریله کردن گروه هیدروکسیل تیروزین،ترئونین و سرین به کار بروند.
علیرغم اینکه این سلول ها گزینه بسیار خوبی برای تولید پروتئین های گلایکوزیله هستند دارای یکسری مشکلات می باشند. این سلول ها ترشح کننده های ضعیفی هستند. بعلاوه فرآیند کشت سلول های پستانداران به منظور تولید پروتئین های نوترکیب به دلیل گران بودن محیط کشت و فاکتورهای رشد پر هزینه است. بعنوان مثال هزینه تولید یک گرم انسولین 375 دلار وبرای تولید هر گرم اریتروپویتین باید 840000 دلار هزینه کرد. فرآیند کشت سلول های پستانداران این پتانسیل را دارد که به وسیله ویروس ها آلوده شود. همچنین انتخاب لاین سلولی مناسب معمولا هفته ها طول می کشد و کشت سلولی تنها برای مدت زمان محدودی پایدار است.
سلول های حشرات
میزبانی که برای کشت درسلول های حشرات استفاده می شود عمدتا Spodoptra Frugiperda است. رایج ترین سیستم وکتوری که برای بیان پروتئین ها در سلول های حشرات استفاده می شود baculovirus است. مزایای استفاده از سلول های حشرات تحت سیستم baculovirus عبارت است از:
- تغییرات پس از ترجمه صورت می گیرد.
- تا شدن پروتئین ها به شیوه مناسبی صورت می گیرد و باندهای دی سولفیدی تشکیل می شوند.
- به دلیل استفاده از پروموتر قوی پروتئین پلی هدرین ، سطح بیان بالاست.
- وکتورهای بیانی که از baculovirus آماده شده اند می توانند به بی مهره گان حمله کنند اما تاثیری روی مهره داران و گیاهان ندارند و بنابراین ایمنی آنها تضمین شده است.
- اندازه ی پروتئین قابل تغییر است.
- برش سیگنال پپتید به شیوه کارآمدی صورت می پذیرد.
- می توان به طور همزمان چندین ژن را بیان کرد.
این سیستم نیز دارای یکسری معایب است. الگوی خاص فرآیند های پس از ترجمه و بیان باید برای هر سازه ای از لحاظ تجربی تعیین گردد. بعلاوه پروتئین های بیان شده توسط سلول های حشرات که با baculovirus آلوده شده اند با پروتئین های بیان شده توسط سلول های پستانداران متفاوت است. در بعضی مواقع پروتئین ها به درستی تا نشده و درون سلول ایجاد لخته های پروتئینی می کنند. سطح بیان پایین است و الگوی گلیکوزیلیشن نادرست است. در آنالیزهای انجام شده مشخص شده جایگاه هایی که دارای پتانسیل N-linked glycosylation هستند اغلب ، یا کاملا گلایکوزیله هستند یا اصلا گلایکوزیله نشده اند که این با فرم های قندی مختلفی که در سلول های پستانداران تولید می شود متفاوت است. استفاده از این سیستم کند و زمان بر می باشد.
به دلیل مسائلی که در بالا ذکر گردید اصولا سیستم baculovirus مزیت های کمتری نسبت به سیستم های دیگر مانند سلول های CHO دارند و تنها در حاشیه تولید پروتئین های دارویی قرار دارند.
قارچ های رشته ای
قارچ های رشته ای نیز می توانند بعنوان میزبان بیانی پروتئین های نوترکیب استفاده گردند. مزایای این سیستم عبارت است از:
- قارچ های رشته ای قابلیت ترشح میزان بالایی از پروتئین ها به فرم فعال را دارا هستند.
- فرآیندهای پس از ترجمه در این میزبان انجام می گردد. به عنوان مثال گلایکوزیلیشن در برخی گونه ها مانند Trichoderma ressi مشابه انسان است.
با وجود این مزایا بازده ترشحی برای برخی پروتئین ها پایین است و در برخی موارد پروتئین های تولید شده توسط پروتئازهای قارچی تخریب می شوند[6].
مخمر
دو سیستم مخمری ،Sacharomyces cerevisiae و Picha pastori برای بیان پروتئین های نوترکیب استفاده می شوند. مخمر قادر است پروتئین هایی با وزن بیشتر از 50 kDa را تولید کند. مزایای این سیستم عبارتند از:
- بازده بالا
- سویه های تولید کننده پایدار
- ماندگاری
- مقرون به صرفه بودن
- رشد با تراکم بالا
- مناسب بودن جهت تولید پروتئین هایی که برچسب ایزوتوپ دارند.
- رشد سریع در محیطی که از نظر شیمیایی تعریف شده است و نیازی به فاکتور رشد ندارد.
- فرآیند تولید مشابه پستانداران
- توانایی ایجاد باندهای دی سولفیدی
- کمک به تا خوردن پروتئین ها
- گلایکوزیله کردن پروتئین ها
- کار کردن با سلول های مخمر نسبت به سلول های پستانداران و حشرات آسان تر و ارزان تر است
- مخمرها به راحتی خود را با فرآیندهای تخمیر سازگار می کنند
- توانایی ترشحی بالایی دارند
- کیت های مبتنی بر مخمرها به راحتی در دسترس است
- به دلیل دیواره مقاومی که دارند حساسیت کمتری به استرس ایجاد شده طی فرآیند تولید از خود نشان می دهند.
گلیکوزیلاسیون مخمرها مشابه پستانداران نیست. گلیکوپروتئین های مخمر به صورت high- mannose است در حالیکه N- گلیکان های انسان عمدتا به صورت هیبرید و کمپلکس است. گلیکوپروتئین های high- mannose در شرایط in vivo نیمه عمر پایینی دارند و ممکن است تاثیر کمی را از خود نشان دهند یا حتی ایمونوژنیک باشند.
1-3-7- E.coli
E.coli اولین و گسترده ترین میزبانی است که برای تولید پروتئین های هترولوگ به کار می رود. بیش از نیمی (55%) از پروتئین های نوترکیب توسط میکروب ها تولید می شوند که 40% آن به وسیله باکتری ها و 15% آن به وسیله مخمر تولید می شود.جالب توجه است که از این 40% سهم مربوط به باکتری ها، 39% را E.coli به خود اختصاص داده است. مزایای این سیستم شامل:
- رشد سریع
- بیان سریع
- کشت آسان و ارزان
- coli بازده تولید بالایی دارد به گونه ای که می توان تا 80% وزن خشک خود را پروتئین هدف تولید کند.
- ژنتیک آن نسبت به سایر میکروارگانیسم ها به خوبی شناسایی شده است.
- برای بیان پروتئین های غیر گلایکوزیله بهترین گزینه است
- ابزار های ژنتیکی برای بهبود آن در دسترس است.
- کنترل پروموتر آن آسان است.
- تعداد کپی پلاسمید را می توان به آسانی تغییر داد.
- به دلیل زمان کوتاه دو نیمه شدن ارزیابی بیان ژن نوترکیب در coli می تواند در کمتر از یک هفته انجام شود.
E.coli نیز علیرغم مزایای بسیاری که دارد با مشکلاتی مواجه است. بیان باند دی سولفیدی در E.coli با مشکل مواجه است. پروتئین هایی که در E.coli تولید می شوند به صورت غیر گلایکوزیله هستند و به همین دلیل آنتی بادی های تولید شده توسط E.coli در شناسایی پروتئین های پستانداران شکست می خورند. پروتئین با اندوتوکسین ها تولید می شود و کشت در تراکم بالا نیز منجربه تولید استات می شود که روی سلول اثر سمی دارد. اصولا پروتئین هایی که در سیتوپلاسم بیان می شوند تشکیل اینکلوژن بادی می دهند و نیازمند باز تا خوردن هستند.همچنین E.coli قادر نیست زیرواحد های پروتئینی را به شیوه ای مناسب سر هم سازد و تولید پروتئین فعال کند.
مشکلات بیان پروتئین
به طور کلی مشکلات مربوط به بیان پروتئین نوترکیب در E.coli را می توان در چهار دسته کلی قرار که این مشکلات به همراه علل آن را می توان به اختصار در جدول2-1 مشاهده نمود:
| مشکل | علت |
| عدم بیان پروتئین و یا بیان به میزان کم
| سمیت پروتئین ارجحیت کدونی |
| شکل گیری اینکلوژن بادی | عدم شکل گیری صحیح باندهای دی سولفیدی تا شدن نادرست حلالیت پایین نیاز به تغییرات پس از ترجمه |
| غیرفعال بودن پروتئین | تا شدن ناقص |
| Publication bias | جذاب بودن نتایج مثبت عدم تمایل محققان به انتشار نتایج منفی تضاد نتایج با منافع شخصی محقق
|
جدول 2-1: مشکلات بیان پروتئین نوترکیب در E.coli و علل آن
عدم بیان پروتئین و یا بیان به میزان کم
این وضعیت ممکن است به عنوان بدترین سناریو ممکن در نظر گرفته شود. در این حالت پروتئین مورد نظر نمی تواند از طریق تکنیک های حساس مانند وسترن بلات شناسایی شود و یا اینکه شناسایی می شود ولی در سطح بسیار پایین(کمتر از میلی گرم در یک لیتر از کشت). اغلب مشکل مربوط می شود به تاثیر مضری که پروتئین هترولوگوس بر روی سلول میزبان دارد. عدم بیان پروتئین می تواند ناشی از دو عامل باشد :1-سمیت پروتئین 2-ارجحیت کدونی
سمیت پروتئین
مشکل سمیت پروتئین ممکن است زمانی ایجاد شود که پروتئین نوترکیب یک عملکرد غیر ضروری یا کشنده بر روی سلول میزبان دارد. این عملکرد با تقسیم سلولی نرمال و هموستازی میکروارگانیسم تداخل پیدا می کند و نتیجه ی آشکار آن سرعت رشد و چگالی سلولی کمتر و مرگ می باشد. سمیت پروتئین می تواند ناشی از دو عامل باشد: سمیت ژنی و بیان پایه ی mRNA/پروتئین سمی ، که سمیت ژنی در اینجا مورد بحث قرار نمی گیرد. به منظور کنترل بیان پایه ی mRNA/پروتئین سمی کنترل سنتز پایه توسط پروموترها یکی از گزینه های پیش رو است. فراهم کردن محیط تعریف شده با استفاده از گلوکز به عنوان منبع کربن نیز می تواند انتخاب مناسبی باشد. راه حل دیگر می تواند حذف پروتئین از سلول باشد.گاهی اوقات ترشح به پری پلاسم یا محیط تنها راه برای تولید یک پروتئین نوترکیب است.
ارجحیت کدونی
بیان پروتئین های هترولوگ در E.coli و سایرمیکروارگانیسم ها به طور قوی تحت تاثیر ارجحیت کدونی قرار دارد . این پدیده زمانی اتفاق می افتد که کدون استفاده شده مربوط به mRNA کد کننده پروتئین خارجی ، با باکتری متفاوت باشد . این گونه تصور می شد که ریبوزوم در مواجه با یک کدون نادر مکث می کند و ممکن است از mRNA جدا شود بنابراین بازده بیان پروتئین کاهش می یابد . بعلاوه گفته شده است که برای بهبود بیان پروتئین ها باید کدون های نادر را از طریق جایگزینی آنها با کدون های رایج حذف کرد. بنابراین جایگزینی کدون های نادر با کدون های رایج یک روش کاربردی مرسوم در بیان ژن های هترولوگوس به منظور افزایش بازده پروتئین است. از سوی دیگر مشاهده شد که در برخی از موارد این جانشینی منجر به کاهش حلالیت و پایداری پروتئین می شود. در واقع طراحی ژن می تواند منجر به تا خوردن غیر طبیعی پروتئین و درنتیجه کاهش در حلالیت و فعالیت پروتئین گردد. به نظر می رسد کدون های AGG/AGA ،AUA،CUA،CGA (به احتمال زیاد CGG) و CCC از نقطه نظر ترجمه در E.coli مشکل ایجاد کنند. مطالعات نشان می دهد برای حل این مشکل می توان از پلاسمید حاوی ژن های tRNA مناسب استفاده کرد و یا با سنتز ژن، این کدون ها را از ژن حذف کرد. استفاده از محیط بیانی مناسب هم تاثیر گزار است. به عنوان مثال DNA مواد حساسیت زای بادام زمینی حاوی میزان زیادی از کدون هایی است که در E.coli به میزان کمی استفاده می شوند ،یعنی AGG/AGA . برای افزایش بیان این پروتئین ها در E.coli سویه BL21(DE3) تغییر یافته و سویه BL21–CodonPlus(DE3)-RIL ایجاد گردید که در آن یک کپی اضافی از ژن های tRNA های argU، ileY و leuW وجود داشت. در نهایت بازده کلی به میزان 100 برابر بیشتر از آنچه بود که به وسیله سویه BL21 به دست می آمد. در مطالعه ی دیگری ژن های پارازیت ها را مورد بررسی قرار دادند. ژن های پارازیت ها اغلب حاوی کدون هایی هستند که به ندرت در ژن های با بیان بالای E.coli حضور دارند. برای بیان ژن های پلاسمودیوم با غلبه بر ارجحیت کدونی ،یک روش مهندسی کردن ژن های پلاسمودیوم است به گونه ای که دارای کدون هایی باشد که در E.coli ترجیح داده می شوند اما این روش هزینه بر و وقت گیر است. بنابراین در این مطالعه از انتقال یک پلاسمید که حاوی ژن های مربوط به tRNA کدون های نادر بود استفاده شد و سطح بیان افزایش یافت. در این روش از پلاسمید RIG استفاده شد که حاوی ژن های سه tRNA ،آرژنین، ایزولوسین و گلایسین بود. استفاده از این پلاسمید سطح بیان پروتئین را به میزان زیادی بالا برد
2-1-2- شکل گیری اینکلوژن بادی
تولید پروتئین های عملکردی در E.coli نیازمند یک تعادل ظرفیت بین رونویسی DNA ، ترجمه پروتئین و تا شدن پروتئین است. بیان بالای پروتئین نوترکیب در E.coli می تواند تا 30 درصد از کل پروتئین تولید شده در سلول میزبان را به خود اختصاص دهد در حالیکه چاپرون ها و مدولیتور ها به شدت دوز مشخصی دارند. علاوه بر این تا شدن صحیح بسیاری از پروتئین ها نیازمند شکل گیری باندهای دی سولفیدی یا گلیگوزیلاسیون است که در E.coli تشکیل نمی شوند. بنابراین بیان بسیاری از پروتئین ها در E.coli مقدار زیادی از پروتئین های تا نشده یا اشتباه تا شده را در سیتوپلاسم ایجاد می کند،جاییکه این پروتئین ها تمایل دارند تجمع یابند و اینکلوژن بادی ها را ایجاد کنند .اینکلوژن بادی ها به صورت غیر فعال و غیر محلول هستند و در بعضی شرایط یک مانع قابل توجه در به دست آوردن پروتئین فعال هستند. با این وجود در برخی از موارد اینکلوژن بادی ها مفید می باشند چرا که تولید با بازده بالا صورت می گیرد، نسبت به پروتئولیز مقاومند، تغلیظ آنها با سانتریفوژ آسان تر است و حداقل آلودگی را با سایر پروتئین ها دارند. بسیاری از داروهای تجاری و توسعه یافته مانند اینترفرون ها و اینترلوکین ها به صورت اینکلوژن بادی تولید می شوند.
یک روش معمول برای پیشبرد بیان پروتئین ها به فرم محلول و جلوگیری از شکل گیری اینکلوژن بادی ها قرار دادن یک تگ در انتهای N- ترمینال و یا C- ترمینال پروتئین است که به افزایش حلالیت پروتئین منجر می شود. فیوژن پارتنرهایی که حلالیت پروتئین های نوترکیب را افزایش می دهند عبارتند از :
Glutathione-S-transferase (GST)
Ubiquitin-modifier (SUMO)
Thioredoxin
Maltose-binding protein (MBP)
N-utilization substrate (NusA)
MPB و GST دارای یک برتری دیگری هم هستند به طوریکه می توان از این ها به عنوان تگ تمایلی هم در خالص سازی استفاده کرد. SUMO ، thioredoxin و NusA برای خالص سازی نیازمند تگ تمایلی هستند که معمولا از His-tag استفاده می شود.thioredoxin به دلیل سایز کوچکی که دارد (11.8 kDa) این امکان را فراهم می کند که پروتئین هدف درصد بیشتری از فیوژن را به خود اختصاص دهد. فیوژن GST در بسیاری از موارد به شدت مستعد شکست پروتئولیتیک است و سبب ایجاد پروتئین های ناکارآمد می شود.SUMO قادر است تا شدن را بهبود بخشد و همچنین حلالیت پروتئین مورد نظر را افزایش دهد این تگ هم مانند thioredoxin سایز کوچکی دارد و قادر است نسبت تقریبا بالای پروتئین به پپتید را فراهم کند که تاثیر مثبتی روی بازده پروتئین دارد.
به طور طبیعی هنگامی که پروتئین نوترکیب در سیتوپلاسم E.coli بیان می شود تشکیل باندهای دی سولفیدی ناکارآمد است . تولید پروتئین های دارای باند دی سولفیدی یک چالش عمده در بحث تولید در مقیاس بالا است. شکل گیری باندهای دی سولفیدی نرمال تنها در پری پلاسم اتفاق می افتد که به وسیله ی سیستم Dsb کاتالیز می شود. در بخش هایی که باند دی سولفیدی به طور طبیعی اتفاق می افتد دو مرحله ی مجزا در بیوسنتز وجود دارد:1- کاتالیز از نو باندهای دی سولفیدی 2- ایزومریزاسیون باندهای ایجاد شده برای رسیدن به باندهای دی سولفیدی نرمال. استراتژی هایی که برای پیشبرد باند های دی سولفیدی در E.coli به کار می رود در دو دسته قرار می گیرند .دسته اول هدایت پلی پپتید در حال تولید به سمت محیط خارجی و دسته دوم تغییر اکسیداسیون سیتوپلاسم تا رسیدن به یک محیط اکسیداتیو مناسب. هدایت پلی پپتید ترجمه شده به فضای پری پلاسمی دلایل فیزیولوژیکال واضحی دارد: 1- پری پلاسم بر عکس سیتوپلاسم حالت اکسید دارد 2- پری پلاسم محل آنزیم های کاتالیز کننده شکل گیری و ایزومریزاسیون باندهای دی سولفیدی است. بعلاوه چاپرون ها و فولدازها ها نیز در این ناحیه قرار دارند. مشاهده شده بیان همزمان پروتئین های خانواده Dsb برای تا خوردن صحیح پروتئین های دارای باند دی سولفیدی کارآمد است. Thioredoxin reductase و Glutathion reductase آنزیم هایی هستند متعلق به سیستم Dsb که سبب می شوند در سیتوپلاسم تیردوکسین و گلوتاردوکسین قادر باشند سیستئسن ها را احیا کنند. اختلال در ژن های trxB و gor می تواند سبب شود در سیتوپلاسم باندهای دی سولفیدی ایجاد گردد. در یک بررسی نشان داده شد که با استفاده از کاتالیزورهایی برای شکل گیری باندهای دی سولفیدی و کاتالیزورهایی برای ایزومریزاسیون باندهای دی سولفیدی می توان مقدار بالایی از پروتئین های دارای باند دی سولفیدی را در سیتوپلاسم E.coli تولید کرد. در این روش از Erv1p که یک سولفهیدریل اکسیداز است به همراه یک دی سولفید ایزومراز استفاده شد.لازم به ذکر است که در این روش نیاز به بر هم زدن مسیرهای احیایی نبود. سویه های ∆gor∆trxB و همچنین سیستم هایی که بیان Dsbc در سیتوپلاسم آنها صورت می گیرد اگرچه پروتئین های دارای باند دی سولفیدی تولید می کنند ولی بازده آنها بسیار پایین است چرا که مسیر از نو ایجاد باندهای دی سولفیدی را ندارند.سولفهیدریل اکسیداز یک کاتالیست طبیعی شکل گیری از نو باندهای دی سولفیدی در E.coli است و امکان تولید پروتئین های دارای باند دی سولفیدی را بدون اختلال در مسیرهای احیایی فراهم می سازد. با استفاده از این روش و اجرای متدهایی مانند حفظ حدواسط های تا خورده به صورت محلول و استفاده از محیط کشت جایگزین سطح بیان پروتئین vtPA که دارای 9 باند دی سولفیدی است به میزان 800 برابر افزایش یافت.
چاپرون های مولکولی پروتئین هایی هستند که به تا خوردن پروتئین ها کمک می کنند. برای جلوگیری از شکل گیری اینکلوژن بادی ها استراتژی بیان همزمان مولکول های چاپرونی در بسیاری از موارد دنبال شده است. در واقع ثابت شده است که بیان همزمان ژن های کد کننده چاپرون ها و پروتئین های هدف در به دست آوردن فرم محلول پروتئین تاثیر گزارند. برای بیان بیشترفرم فعال D-ANase، D-AGase و D-AAase در E.coli، از بیان همزمان چاپرون های مختلف استفاده شد و در نهایت مشاهده گردید که بیان همزمان چاپرون های GroELS و TF با D-ANase و D-AGase به ترتیب میزان بیانشان را 1.3 برابر و 1.8 برابر افزایش یافته و پروتئین ها را به فرم فعال تولید می کنند. بیان همزمان D-AAase با ژن TF منجر به افزایش 4.3 برابری در فعالیت آن گردید. اندوستاتین پروتئینی است که به فرم اینکلوژن بادی در E.coli تولید می شود. بیان این پروتئین به همراه بیان همزمان چاپرون های Dnak-DnaJ-GrpE و GroEL/ES به همراه تخمیر در دمای پایین(16 درجه سانتی گراد) به میزان زیادی در جلوگیری از لخته شدن اندوستاتین هنگام بالا بردن میزان بیان موثر بود. در بررسی دیگر Neuronal nitric oxid synthase(nNOS) با کمک چاپرون ها به فرم فعال و بازده بالا در E.coli بیان گردید. به کمک این روش موفق به تولید 20-24mg از nNOS در هر لیتر از سلول شدند حال آنکه میزان تولید nNOS در 20 لیتر از کشت سلول های human kidney 293 تنها 8-10mg بود. از طرف دیگر تولید nNOS با سیستم baculovirus هم منجر به تولید فرم غیر فعال nNOS شد چرا که این سیتم قادر نیست مولکول هِم را به درستی در ساختار nNOS قرار دهد. بنابراین این روش هر دو مشکل بازده پایین و غیر فعال بودن محصول را برطرف کرد.علت موفقیت این روش را می توان به 3 عامل نسبت داد:1-استفاده از وکتور pWC که در پیشبرد قرار گیری مناسب هِم در ساختار nNOS نقش دارد و در نتیجه پروتئین را به فرم فعال تولید می کند2- بیان همزمان چاپرون های GroEL و GroES 3- استفاده از سویه BL21 که پروتئاز های آن غیرفعال گردیده بود. در نبود چاپرون ها بیان Nnos در سویه BL21 غیر قابل تشخیص بود. در مطالعه دیگر از یک روش دو مرحله ای برای افزایش بیان پروتئین ها به فرم محلول استفاده شد.در مرحله اول چهار سیستم چاپرونی GroEL/GroES ، DnaK/DnaJ/GrpE ، ClpB و HSP های کوچک bpA/IbpB به صورت هماهنگ با پروتئین های نوترکیب co-overproduce شدند. در مرحله دوم بیوسنتز پروتئین مهار شد تا به چاپرون ها اجازه داده شود که تا شدن دوباره پروتئین هایی که به درستی تا نشده اند و تشکیل لخته های پروتئین داده اند را انجام دهند. .این روش حلالیت 70 درصد از پروتئین هایی را که بررسی شده بودند را به میزان 42 برابر افزایش داد.
یکی از ساده ترین روش ها برای به حداقل رساندن شکل گیری اینکلوژن بادی ها کاهش دما است. عموما بیان در دمای پایین منجر به افزایش حلالیت و تا خوردن صحیح می شود. این امر ناشی از این مساله است که اینترکشن های هیدروفوبیک که تعیین کننده اینکلوژن بادی ها هستند وابسته به دما می باشند. از سویی احتمالا کاهش دما سرعت رونویسی، ترجمه و باز تا شدن را پایین می آورد و بنابراین اجازه شکل گیری تا خوردن صحیح را می دهد. جدای از این هر نوع بیانی که در رابطه با فنوتیپ سمی است و در دمای 37 درجه دیده می شود ، در دماهای پایین سرکوب می گردد. همچنین در دمای پایین افزایش بیان و فعالیت شماری از چاپرون ها در E.coli گزارش شده است. مشاهده شده که پروتئازهای شوک حرارتی که طی افزایش بیان القا می شوند در شرایط دمایی پایین فعالیت کمتری دارند و بنابراین رشد در رنج دمایی 15-23 درجه سانتی گراد منجر به کاهش قابل توجهی در تخریب پروتئین نوترکیب می شود. در یک بررسی مشخص شد که القای Human phosphodioesterase(PDE-3A,PDE-5A) و P38-α map kinase به ترتیب در 22 درجه و 18 درجه منجر به افزایش تولید این آنزیم ها به فرم فعال می شود.اگرچه واضح است که رشد در درجه حرارت پایین معایبی خواهد داشت که می تواند شامل کاهش رونویسی و ترجمه و در نتیجه سرعت پایین تغییر و تبدیل پروتئین های نوترکیب گردد. در بررسی دیگری از ویژگی ژن cspA برای بهبود یکسری از وکتورهای بیانی که pCOLD نامیده می شوند استفاده شد.این وکتور پس از القا به وسیله ی شوک سرمایی بیان بالای ژن های کلون شده را تحریک می کند.
غیرفعال بودن پروتئین
به دست آوردن یک مقدار مطلوب از پروتئین نوترکیب پایان راه نیست.پروتئین ممکن است هنوز دارای کیفیت پایینی باشد.به عنوان مثال دارای فعالیت مناسب نباشد و یا به طور ناقص تا خوردده باشد.در این حالت پروتئین یک کنفورماسیون محلول پایدار می گیرد اما معماری دقیق جایگاه فعال هنوز برای فعالیت مناسب نیست.برخی از مواردی که در بالا توضیح داده شد می توانند در این مورد هم مفید باشند.
برخی پروتئین ها برای کسب کنفورماسیون تا شده نهایی نیازمند مولکول های کوچک یا گروه های پروتئولیتیک هستند. اضافه کردن این ترکیبات به محیط کشت می تواند بازده و کیفیت پروتئین بیان شده را به طور قابل توجهی افزایش دهد. شکل گیری باندهای دی سولفید اشتباه نیز می تواند منجر به غیر فعال شدن پروتئین شود.علاوه بر این تولید پروتئین در دماهای پایین تر دارای یک تاثیر عمیق بر کیفیت پروتئین است.
Publication bias
Publication bias یک پدیده شناخته شده در رابطه با متون کلینیکال و تجربی است، به طوریکه تحقیقاتی که منجر به نتایج مثبت شده اند نسبت به تحقیقات با نتیجه ی منفی شانس بیشتری برای چاپ شدن در مجلات علمی را دارا هستند. علت این پدیده می تواند ناشی از سه فاکتور باشد:
- جذاب بودن نتایج مثبت
- عدم تمایل محققان به انتشار نتایج منفی
- تضاد نتایج با منافع شخصی محقق
متاسفانه به دلیل عدم چاپ مقالات دارای نتیجه ی منفی، خود به خود بخش اعظمی از اطلاعات در رابطه با بیان پروتئین نوترکیب از دسترس خارج می گردد. به منظور حل این مشکل ژورنال هایی تاسیس شده اند که به طور ویژه مقالات دارای نتایج منفی را منتشر می کنند.
نتیجه گیری:
از لحاظ بیان نوترکیب، E.coli اغلب کارخانه سلولی میکروبی است که ترجیح داده می شود. E.coli میزبان مناسبی برای بیان پروتئین هایی که الگوی تا شدن پایداری دارند و یا پروتئین های گلوبولار پروکاریوت ها و یوکاریوت ها می باشد. اگرچه بیان پروتئین های غشایی و پروتئین های با وزن مولکولی بیشتر از kDa66 با مشکل مواجه است ،گزارش های موفقیت آمیزی در این زمینه ارائه شده است(پروتئین های گیاهی با وزن kDa 95-90 در آزمایشگاه ها تولید شده است). آزمایشات بیان پروتئین در مقیاس بالا نشان داده است که کمتر از 50% پروتئین های باکتریایی و کمتر از 15% از پروتئین های غیرباکتریایی می توانند به فرم محلول در E.coli بیان شوند که این امر نشان دهنده ی تطبیق پذیری سیستم است. با این وجود زمانیکه می خواهیم یک پروتئین که بیان آن مشکل است را بیان کنیم این مساله می تواند پیچیده شود. در متنی که پیش رو دارید تلاش ما بر این بود که یک راهنمای نسبتا جامعی برای مواجه با چالش های پیشروی بیان پروتئین نوترکیب در E.coli را ارائه نماییم. با این وجود در اینجا یک واژه “احتیاط” ضروریست. متاسفانه بسیاری از رویکردهایی که ارائه گردید در عمل در بسیاری از موارد با شکست مواجه می شوند. در واقع می توان گفت استراتژی هایی که به منظور راه حل برای بیان پروتئین های نوترکیب به کار می روند اغلب ویژه ی پروتئین هستند. به لطف تلاش های جامعه ی علمی، روش های کلی مربوط به بیان پروتئین های نوترکیب به صورت پراکنده نیستند و می توانند به طور سیستماتیک استفاده شوند. علاوه بر این، این رشته به قدری گسترده است که حتی پس از گذشت تقریبا 40 سال از دست یابی به اولین پروتئین انسانی در E.coli هنوز بخش های زیادی در این دانش وجود دارد که می بایست بهبود بخشیده شوند.از سوی دیگر پیشرفت های اخیر در بیان پروتئین های پیچیده مانند آنتی بادی ها گلایکوزیله با طول کامل، مهندسی سویه های جدید و N- گلایکوزیلیشن باکتریایی پیشنهاد می کنند که پروتئین های پیچیده و گلایکوپروتئین ها نیز ممکن است در آینده ای نزدیک در E.coli در مقادیر بالا سنتز شوند.












نقد و بررسیها
هنوز بررسیای ثبت نشده است.