- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
استخراج DNA

تخلیص DNA:
منابع DNA استفاده شونده در روند مهندسی ژنتیک شامل DNA تام، DNA پلاسمیدی و DNA فاژی می باشد. DNA تام و DNA پلاسمیدی از محیط های کشت باکتریایی جدا سازی می شوند، اما DNA فاژی از ذرات باکتریوفاژی که از سلول های آلوده آزاد شده اند جداسازی می شود.
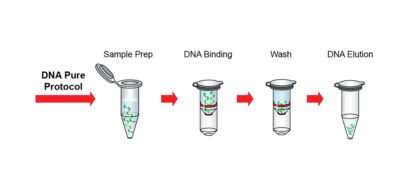
تهیه DNA تام سلول باکتریایی
تهیه DNA از سلول های باکتریایی شامل مراحل می باشد:
- کشت
- شکست سلولی
- به دست اوردن DNA از عصاره سلولی
- تغلیظ محلول DNA به دست آمده
برای رشد باکتری ها جهت استخراج DNA آنها ابتدا کلنی های مورد نظر شکل گرفته بر روی محیط کشت جامد به یک محیط کشت مایع انتقال داده می شود، در این محیط های کشت سعی می شود یک آنتی بیوتیک که باکتری مورد نظر به آن مقاومت دارد فراهم شود تا از رشد سایر آلودگی ها جلوگیری شود. اکثر باکتری ها می توانند در محیط کشت مایع رشد کنند.
محیط محیطهای کشت به صورت کلی به دو شکل محیط های کشت معین (به منظور کشت در شرایط تحت کنترل یا کشت های صعنتی) و محیط های کشت نامعین تقسیم بندی می شوند، در محیط های کشت معین همه اجزای تشکیل دهنده محیط کشت شناخته شده می باشد و این مواد شامل مخلوی از مواد غیرآلی جهت تهیه عناصر ضروری مثل نیتروژن، منیزیوم، وکلسیم همچنین گلوکز جهت تامین کربن و انرژی است.
محیط کشت M9 یک محیط کشت معین می باشد، این محیط کشت به صورت عملی برای رشد باکتری ها احتیاج به افزوده شدن فاکتورهای رشدی مثل عناصر کمیاب و ویتامین ها می باشد.
در محیط های کشت نامعین(به منظور کشت های صرفا جهت تهیه منبع DNA) اجزای محیط کشت و مقادیر آن ها به صورت دقیق شناخته شده نمی باشد. یکی از محیط های کشت نامعین عبارت است از محیط LB یا لوریا برتانی. دو ترکیب در این محیط کشت یعنی تریپتون و عصاره مخمر ترکیباتی هستند که به صورت دقیق محتوای شیمیایی آن ها شناسایی نشده است.
- تریپتون اسید آمینه و پپتیدهای کوچک را تامین می کند
- عصاره مخمر نیتروژن ، قندها و مواد مغذی آلی را تعیمین می کند
محیط های کشد نامعین مثل LB برای ایجاد محیط مناسب جهت رشد به مواد افزودنی احتیاج ندارند.
برای تهیه عصاره سلولی می باید باکتری ها در کمترین میزان ممکن از محیط کشت رشد کنند، برای جداسازی باکتری های از محیط کشت از سانترفیوژ یا فیلتراسیون استفاده می شود.

تهیه عصاره
برای تهیه عصاره سلولی می بایست ابتدا غشاها و دیواره های اطراف سلول باکتری شکسته شود، که این شکستن توسط روش های فیزیکی و شیمیایی انجام می شود.
روش شیمیایی مرسوم برای باکتری E.Coli استفاده از لیزوزیم، EDTA و یاترکیبی از هر دوی این مواد می باشد.
لیزوزیم باعث شکسته شده لیپوپلی ساکارید در دیواره باکتری های گرم منفی همچنین شکسته شدن پلی ساکارید در باکتری های گرم مثبت می شود.
EDTA یک عامل شلاته کننده است که باعث خروج یون منیزیوم از ساختار پوشش سلول می شود، که این کار باعث سست شدن پوشش و از بین رفتن آن می شود.
برای لیز استفاده از مواد گفته شده کافی می باشد اما در اکثر موارد از ماده سدیم دو دسیل سولفانات یا SDS نیز استفاده می شود. این ماده یک دترژنت می باشد که از طریق خارج کردن مولکول های لیپید به فرایند لیز شدن کمک می کند و باعث خرد شدن غشای سلول می شود.
در نهایت توسط سانترفیوژ اجزای نامحلول از عصاره سلولی جدا می شود که این هدف با استفاده از روش های متفاوتی انجام می گیرد.
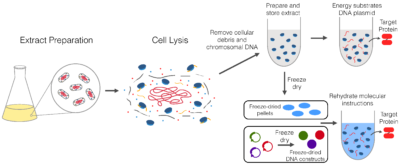
تخلیص DNA از عصاره سلولی
در عصاره سلولی علاوه بر DNA میزان بالایی از پروتئین و RNA نیز حضور دارد، برای جداسازی این ها می توان از روش های متفاوتی استفاده کرد.
- جدا کردن آلودگی ها توسط عصاره ی مواد آلی و هضم آنزیمی
در این روش با افزودن فنل یا مخلوط 1:1 فنل و کلروفرم که حلالهای آلی هستند باعث رسوب پروتئین می شوند اما اسیدهای نوکلئیک در فاز آبی باقی می مانند که در مرحله بعد می توان آن ها را از فاز آبی جدا کرد. به واسطه اینکه در این روش میزانی از پروتئین در فاز آبی نیز باقی می ماند می توان چند مرحله شستشو با این مخلوط را انجام داد. اما این عمل می تواند باعث شکسته شدن مولکول های DNA بشود. روش جایگزین این است که عصاره سلولی را قبل از استخراج با فنل با پروتئیناز K تیمار کرد که همین باعث شکستن پروتئین ها و افزایش احتمال خارج شدن آنها در مراحل شستشو می شود.
در این روش همانطور که گفته شد RNA به همراه DNA وارد فاز آبی می شود که برای حذف کردن آن از آنزیم ریبونوکلئاز استفاده می شود.
- کروماتوگرافی تعویض یونی
در این روش ازکروماتوگرافی ستونی استفاده می شود.
- DNA و RNA همانند برخی از پروتئین ها بار منفی دارند و به رزین های با بار مثبت متصل می شوند
- اما با کمک نمک پیوندهای الکتریکی از بین می رود
- خارج سازی مولکول هایی که بار الکتریکی و در نتیجه اتصال محکمتری دارند
- به میزان بالاتری از غلظت نمک احتیاج دارد
- پس با افزایش تدریجی غلظت نمک انواع مختلف مولکول(بر اساس بار الکتریکی) از هم جدا می شوند
در این روش از دو محلول نمکی در این روش استفاده می شود:
- محلول اول برای شستن و خروج پروتئین ها و RNA (در این مرحله DNA در ستون باقی می ماند)
- محلول دوم که غلطت نمک در آن بالاتر است برای جداسازی DNA استفاده می شود
- به کارگیری سیلیکا
در این روش DNA در حضور گوانیدیوم تیوسیانات به ذرات سیلیکا متصل می شود. پس در این روش هم مثل حالت قبل عصاره سلولی وارد ستون کروماتوگرافی حاوی سیلیکا در حضور گوانیدیوم تیوسیانات می شود. پس از اینکه در اثر اتصال DNA سایر آلودگی ها خارج شدند با عبور دادن آب که باعث ناپایداری اتصال DNA و سیلیکا می شود DNA از ستون خارج می شود.
این روش حالت های متنوع دیگری نیز دارد،
الف:
- مهره های سیلیسی به همراه گوانیدیوم تیوسیانات به عصاره سلولی اضافه می شود
- پس از اتصال یافتن و با کمک سانترفیوژ پلت های حاوی DNA جدا می شود
- با اضافه کردن پلت ها به محلول آبی DNA را از مهره های سیلیسی جدا می شود
ب:
- مهره های مغناطیسی پوشیده شده با سیلیس در حضور گوانیدیوم تیوسیانات با عصاره سلولی مخلوط می شود
- با استفاده از یک آهنربا مهره هایی که در سطح آن ها DNA نیز متصل شده است جدا می شود
- در نهایت در این حالت نیز با اضافه کردن پلت ها به محلول آبی DNA را از مهره ها جدا کرد (در این حالت هم سرعت بیشتر بوده و جداسازی ساده تر و بدون استفاده از ستون کروماتوگرافی و یا سانترفیوژ انجام می شود)
گوانیدیوم تیوسیانات یک عامل کائوتروپیک (Caotropic)- عاملی که قادر به شکستن پیوندهای هیدروژنی می باشد- است که قدرت از بین بردن غشا و دناتوره کردن پروتئین ها را دارد، علاوه بر استفاده در روش بالا از این عامل می توان برای از بین بردن غشای همه سلول هایی که فاقد دیواره می باشند جهت استخراج DNA استفاده کرد.
ستیل تری متیل آمونیوم بروماید یا CTAB ماده ای است که با اسیدهای نوکلئیک ایجاد پیوند کرده و آن ها را به صورت غیر محلول رسوب می دهد. از این عامل برای استخراجDNA از سلول هایی با ترکیبات پیچیده به ویژه سلول های گیاهی که میزان زیادی کربوهیدرات دارند استفاده می شود، با اضافه کردن این عمل به این عصاره این سلول ها این ماده باعث رسوب اسیدهای نوکلئیک و جدا شدن آن ها از سایر آلودگی ها مثل کربوهیدارت ها و پروتئین ها می شود. در نهایت این رسوب توسط سانترفیوژ جدا شده و در محلول 1مولار کلرید کلسیم ارتباط بین CTAB و اسیدهای نوکلئیک شکسته شده، از طریق تیمار با ریبونوکلئاز (تجزیه RNA) و رسوب دهی اتانولی در نهایت DNA تخلیص می شود.
همچنین برای خالص سازی بیشتر DNA می توان از رزین های شرکت کیاژن استفاده کرد که شامل مهره های سیلیسی هستند که بر روی آنها ترکیب DEAE دی اتیل آمینو اتیل متصل است که به گروه های فسفات با بار منفی DNA متصل می شود و پس از خارج شدن سایر ناخالصی و اضافه کردن نمک های غلیظ DNA از این ترکیبات جدا می شود.

تغلیظ نمونه ها
پس از تخلیص DNA در عصاره سلولی مشکل عمده غلظت پایین DNA می باشد که به همین دلیل می باید تمهیداتی برای افزایش غلظت در نظر گرفته شود، متداول ترین روش، رسوب دهی با اتانول است:
- اتانول مطلق در حضور نمک کاتیون های تک ظرفیتی مثل ( Na+) و درجه برودت ̊C20- یا کمتر موجب رسوب DNA می شود
- در محلول غلیظ DNA، اتانول با قرارگیری به صورت لایه ای روی نمونه موجب رسوب مولکولها بین دو فاز میشود.
- رشته های DNA را می توان با یک میله شیشه ای بیرون کشید
- در غلظت های کمتر DNA، رسوب DNA را می توان با سانتریفوژ جدا کرد
- مزیت رسوب دهی با اتانول باقی ماندن زنجیره های کوچک و مونومرهای اسید نوکلئیک در محلول است که از عملکرد ریبونوکلئاز حاصل شده بود.
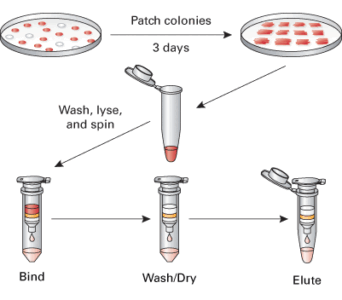
جداسازی DNA پلاسمیدی
روند استخراج DNAپلاسمیدی همانند روند توضیح داده شده در بالا می باشد، زیرا این DNA نیز همزمان با DNA ژنومی از سلول باکتریایی جدا می شود، به همین منظور برای به دست آوردن DNA می باید روشهای مناسبی استفاده شود ، DNA پلاسمیدی بر دو اساس قابل جداسازی است.
الف: براساس اندازه
- بزرگترین پلاسمیدها فقط 8٪ اندازه کروموزوم E.Coli هستند
- در این روش لیز سلولی به آرامی انجام می شود در حدی که قطعات ژنومی باکتریایی تا حد ممکن دست نخورده، بزرگ و به صورت متصل به غشا باقی بمانند که از نظر اندازه قابل جداسازی از DNA پلاسمیدی باشد
- از EDTA و لیزوزیم در حضور سوکروز برای ایجاد اسفروپلاستها (Sphaeroplasts) استفاده میشود تا تجزیه سلول به آرامی انجام گیرد.
- اسفروپلاست، سلولی است که بخشی از دیواره سلولی خود را از دست داده، ولی غشای سیتوپلاسمی آن دست نخورده باقی مانده است.
- تجزیه سلولی با افزودن یک شوینده غیریونی مانند TritonX-100 انجام میگیرد که در حد ناچیزی باعث شکستن کروموزوم باکتری میشود(شوینده های یونی نظیر SDS باعث شکستن کروموزوم میشوند). پس از سانتریفوژ، به واسطه این که بخش اعظم ژنوم باکتریایی به صورت بزرگ و متصل به غشای سلولی قرار دارد همراه با سایر خرده های غشا رسوب می کند. عصاره شفافی بجا می ماند که کاملاً حاوی DNA پلاسمیدی است.
ب: بر اساس ساختار فضایی که به دو روش قابل انجام است:
ابتدا با افزودن NaOH (pH در محدوده 12 تا 5/12) به سل لایزت (Cell lysate) DNA های موجود در عصاره سلولی دناتوره می شوند و سپس با برگرداندن شرایط به حالت خنثی عمل رناتوراسیون انجام می شود.
در حین رناتوراسیون DNA ژنومی به علت این که بخش های مکمل به علت آزاد بودن انتهایشان از هم جدا شده اند، نمی توانند مجدد به صورت صحیح تشکیل جفت باز دهند. به همین علت به صورت کلاف هایی در آمده که چگالی بالایی خواهد داشت. اما برای پلاسمیدها در حین رناتوراسیون به علت اینکه انتهای دو رشته آزاد نبوده و این دو رشته امکان جدا شدن از یکدیگر را ندارند پس مجدد می توانند ایجاد دو رشته ای سوپرکویل کرده به همین دلیل کلاف نمی شوند پس افزایش چگالی نخواهند داشت. به واسطه تفاوت های ایجاد شده در چگالی DNAهای ژنومی و پلاسمیدی،DNA پلاسمیدی پس از سانترفیوژ در شیب چگالی در وسط لوله تجمع یافته و DNA ژنومی در پایین لوله لخته می شود و از بخش میانی می تواند DNA پلاسمیدی را جدا سازی کرد.
مزیت این روش رسوب پروتئینها و RNA و عدم نیاز به استخراج با فنل یاکروماتوگرافی است.
2- سانتریفوژ در شیب چگالی اتیدیوم بروماید – سزیم کلرید (EtBr-CsCl)
این روش، نوع خاصی از سانتریفوژ تعادلی یا سانتریفوژ در شیب چگالی است.
شیب چگالی توسط سزیم کلرید در سرعت بالا ایجاد شده و ماکرومولکولها طبق چگالی شناوری خود نوارهایی را در نقاط معینی در محلول تشکیل میدهند. پروتئین درسطح محلول، DNA در چگالی g/cm3 7/1 و RNA در ته لوله قرار میگیرد.
همچنین اتیدیوم بروماید هم با قرارگیری بین جفت بازهای مجاورِ هم و بازنمودن مقداری از پیچهای مارپیچ دوتایی موجب کاهش چگالی شناوری برای DNA خطی و ابرمارپیچ به ترتیب به مقدار g/cm3 125/0 و g/cm3 085/0 میشود. درنتیجه، مولکولهای ابرمارپیچ (پلاسمیدی ccc) نسبت به DNA حلقوی باز (پلاسمید OC) و خطی (کروموزومی که در طی مراحل تهیه عصاره سلولی شکسته میشود) نوارهای متفاوتی تشکیل میدهند.
موقعیت نوارهای DNA با تاباندن نور UV به لوله مشخص میشود و با سوراخ نمودن کنار لوله با استفاده از سرنگ، DNA پلاسمیدی 100٪ خالص استخراج میشود. اتیدیوم بروماید متصل به DNA پلاسمیدی را با بوتانولنرمال و سزیم کلرید را با دیالیز حذف میکنند.
تکثیر پلاسمید
هدف، افزایش تعداد نسخههای پلاسمید است.
برخی پلاسمیدهای چند نسخهای (به تعداد 20 یا بیشتر) در غیاب پروتئین سازی توانایی همانند سازی دارند، درحالی که کروموزوم باکتری قادر به همانند سازی نیست.
پس از تکثیر سلول تا حد دلخواه، کلرامفنیکل (مهارکننده پروتئین سازی) افزوده شده و تا 12 ساعت انکوباسیون ادامه مییابد در این حالت به علت اینکه امکان پروتئین سازی وجود ندارد همانندسازی DNA باکتریایی انجام نمی شود پس تقسیم سلولی نیز انجام نمی شود به همین دلیل پلاسمید به میزان زیادی تکثیر می شود که می توان در این مرحله آن را استخراج کرد.
تهیه DNA باکتریوفاژ
برای تهیه DNA فاژی احتیاجی به لیز سلولی نمی باشد زیرا فاژها در محیط خارج سلولی وجود دارند. برای جداسازی فاژها از محیط سلولی می توان از سانترفیوژ استفاده کرد، پس از سانترفیوژ فاژ ها در مایع رویی قرار گرفته سلول های زنده و خرده های سلول ها در پایین رسوب می کنند.
از مشکلات مهم در حین استخراج DNA فاژی رسیدن به غلظت بالایی فاژ ها جهت استخراج میزان مناسبی از غلظت DNA می باشد.
تهیه مقادیر زیاد فاژλ
- یک کشت آلوده به λ به طور عمده شامل سلول هایی است که پروفاژ (چرخه لیزوژن) را در شکل ادغام شده درون DNA باکتریایی خود حمل میکند. برای بدست آوردن مقادیر زیاد λ خارج سلولی،کشت باکتریایی تحریک میشود. بدین منظور از سویههای آزمایشگاهی λ دارای جهش حساس به حرارت (ts) در ژن cl (مسئول نگهداری فاژ در حالت لیزوژنی) استفاده میشود. ژن cl جهش یافته در°C30 فعال است ولی در دمای °C42 درست عمل نمی کند و فاژ clts را میتوان با تغییر درجه حرارت از °C30 به °C42 برای تولید فاژهای خارج سلولی القا نمود.
- در سویههایی از λ که ژن cl آنها کاملاً حذف شده است (فاژ غیر لیزوژنیک) سن کشت و مقدار فاژ تلقیحی طوری باید تنظیم شود که کشت به رشد خود ادامه دهد ولی در نهایت تمام سلولها آلوده و تخریب شوند.
- حداکثر تعداد قابل انتظار برای λ برابر 1010 ذره در هر ml است که از آن ng500 از DNA بدست می آید. پس باید از حجم کشت بیشتری استفاده نمود (1000- 500 ml)
مراحل جمعآوری فاژها از کشت آلوده و تهیه DNA خالص
- سانتریفوژ کشت آلوده و معلق ماندن ذرات فاژ در سلول رویی
- افزودن PEG که در حضور نمک با جذب آب موجب رسوب تجمعات ذرات فاژ میشود.
- استفاده از شیب چگالی CsCl برای حذف اجساد باکتریایی و DNA کروموزومی ناخواسته در صورت لزوم
- خارج کردن CsCl با دیالیز
- استخراج DNA بواسطه هضم پوشش پروتئینی فاژ با فنل یا پروتئاز
- ذرات لامبدا در شیب چگالی CsCl در چگالی g/cm3 5/1 45/1 تجمع مییابند.
- فرم همانند ساز M13 با روشی نظیر سانتریفوژ در شیب چگالی EtBr-CsCl از DNA باکتریایی قابل جداسازی است.
- فرم تک رشتهای M13به داخل محیط میریزند و تخریب سلولی اتفاق نمیافتد پس نیازی به حذف بقایای سلولی در سوسپانسیون فاژی نیست.
- بدون دستکاری خاصی، میزان 1012 ذره در ml از فاژ را درکشتهای با حجم کم (ml 5 یا کمتر) قابل دستیابی است و در نتیجه مقدار قابل توجهی ssDNA از فاژ M13 را میتوان بدست آورد.
1) رشد حجم کوچکی از کشت آلوده و جمعآوری باکتریها با سانتریفوژ
2) رسوب ذرات فاژ با PEG
3) حذف پوشش پروتئینی فاژ با فنل
4) تغلیظ DNA به روش رسوبدهی با اتانول

