- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
فناوری نانو

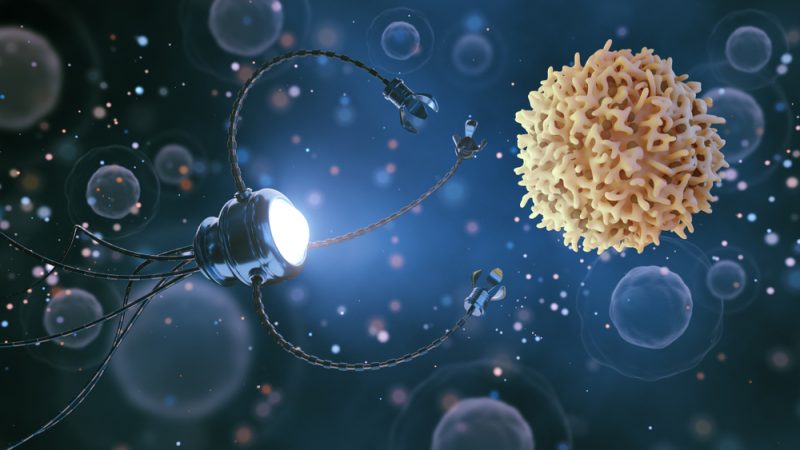
۱- فناوری نانو در تشخیص بیماریها
فناوری نانو امکان تشخیص بیماریها را با روشهای نوین و دقت و سرعت زیاد و هزینۀکم فراهم کرده است. این موارد را میتوان مهمترین مزیتهای استفاده از نانوساختارها در تشخیص بیماریها دانست. فناوری نانو فرصتهای بسیاری پیشروی بهداشت و سلامت جوامع انسانی گذاشته كه استفاده از آنها بر توانایی بشر برای مقابله با بیماریهایی مانند انواع سرطانها افزوده است. در حال حاضر، روشهای متنوعی برپایۀ فناوری نانو برای تشخیص بیماریها گسترش یافته و تجاری شده است و روز به روز نیز به تعداد آنها افزوده میشود.
۱-۱- نانوزیستحسگرها
حسگرها ادواتی هستند که با استفاده از آنها میتوان اقدام به آشکارسازیها و سنجشهای مختلف کرد. گیرندههای موجود در بدن؛ مانند گیرندههای فشاری، دمایی و چشایی اطلاعات لازم برای درک وضعیت بدن را به مغز ارسال میکنند. با دقت، به ساختار این حسگرهای درونی بدن متوجه خواهید شد که قسمتی از این گیرندهها، تغییرات متغیر مورد نظر را دریافت و حس میکند. متغیر همان چیزی است که قرار است بررسی شود و آن را به شکل کلی، آنالیت مینامند. براي مثال، در گیرندة چشایی، مولکولهای سطحی میتوانند به مولکولهای غذا در دهان متصل شوند و بنابراین، وجود آن را در محیط تشخیص دهند. در اینجا، مولکولهای غذا نقش آنالیت را دارند. پس از حس کردن وجود یا تغییر متغیر، پیامی به صورت تکانههای الکتریکی از طریق اعصاب به سیستم عصبی مرکزی ارسال میگردد. این پیام با تغییرات متغیر متناسب و مرتبط است. در نهایت، دستگاه عصبی مرکزی و به ویژه قشر مغز، پیامهای دریافتی از گیرندهها را به نحوی ترجمه میکند که برای ما قابل درک باشد؛ مثلاً مزه ترش آبلیمو!
حسگر وسیلهای است که میتواند یک متغیر را شناسایی كند و حضور، فعالیت و مقدار آن را مخابره نماید. حسگر باید پس از شناسایی و سنجش متغیر هدف، پیغام یا سیگنالی را مخابره و به نحوی ترجمه کند که برای گیرنده پاییندست قابل درک باشد. یک حسگر مناسب باید ویژگیهای خاصی داشتهباشد؛ از جمله: پاسخ سریع، سرعت بازیافت مناسب، حساسیت نسبت به وجود یا تغییرات آنالیت با محدوده مناسب، بازگشتپذیری و قابلیت مصرف چندباره، قیمت مناسب، و در نهایت، انتخابپذیری زیاد.
مهمترین بخش تمامی حسگرها، قسمتي است که وظیفه اندرکنش با آنالیت را برعهده دارد و امکان آشکارسازی و سنجش آن را فراهم میکند؛ این جزء را شناساگر مینامیم اندرکنش آنالیت و شناساگر که برای شناسایی متغیرهای مختلف بکار میرود، میتواند به صورت شیمیایی، الکتریکی، الکترواستاتیکی و مکانیکی باشد. در نهایت، خروجی این اندرکنش بهصورت پیغامی است که قابلیت آشکارسازی و ترجمه را دارد. سادهترین نوع پیغام میتواند به صورت تغییر رنگ باشد اما امروزه مطلوبترین پیغام حاصل از اندرکنش جزء شناساگر و آنالیت، پیغام الکتریکی است که علاوه بر امکان شناسایی آنالیت، سنجش کمّی آن را نیز مقدور میکند.
حال اگر بخشی از جزء شناساگر یک حسگر از مولکولها و ساختارهای زیستی تشکیل شدهباشد یا فرایند آشکارسازی و سنجش مبتنی بر فرایندي زیستی باشد، یک زیستحسگر خواهیم داشت. مولکولهای مورد استفاده در یک زیستحسگر ممكن است از انواع مختلفی باشند؛ از جمله پادتن، پادگن، اسیدهای نوکلوئیک، آنزیمها، تک رشتههای DNA و بسیاری از ساختارهای زیستی، که توان اندرکنش با محرکهای مختلف در محیط پیرامون را دارند. یک سامانه کامل زیستحسگر دارای سه بخش اصلی است: شناساگر یا گیرنده زیستی که با آنالیت اندرکنش ميدهد و پیغام اولیه را ایجاد میکند، مبدّل که وظیفه آشکارسازی و سنجش آنالیت و تولید پیغام قابل ترجمه را برعهده دارد و بخش الکترونیکی که ترجمه پیغام ارسالی را انجام میدهد. بخش الکترونیکی زیستحسگر دارای سه بخش تقویتکننده سیگنال، پردازشگر سیگنال و نمایشگر است. در شکل ۱ بخشهای مختلف یک زیستحسگر به همراه مثالهایی برای اجزای اصلی نشان داده شدهاست. به طور خلاصه، فرایند تشخیص و اندازهگیری در یک زیستحسگر به این صورت انجام میگیرد: پس از شناسایی متغیر توسط مولکول زیستی (گیرنده)، پیغام اولیهای تولید میشود که توسط بخش مبدّل حسگر به بخش الکترونیکی ارسال میشود. پیغام اولیه به تقویتکننده سیگنال در بخش الکترونیکی ميرسد و پس از تقویت، به واحد پردازش که وظیفه ترجمه پیغام را بر عهده دارد، تحویل داده میشود. در نهایت، نمایشگر زیستحسگر پیغام اولیه را كه اكنون ترجمه هم شدهاست، به کاربر منتقل میكند. انواع گوناگونی از مبدلها وجود دارند که از ترکیب مولکولهای زیستی، بهعنوان دریافتکننده و پدیدههای فیزیکی قابل تبدیل به پیغام الکتریکی مانند پدیدههای نوری، الکتروشیمیایی، جرمی و حرارتی برای آشکار سازی و سنجش بهره میبرند.
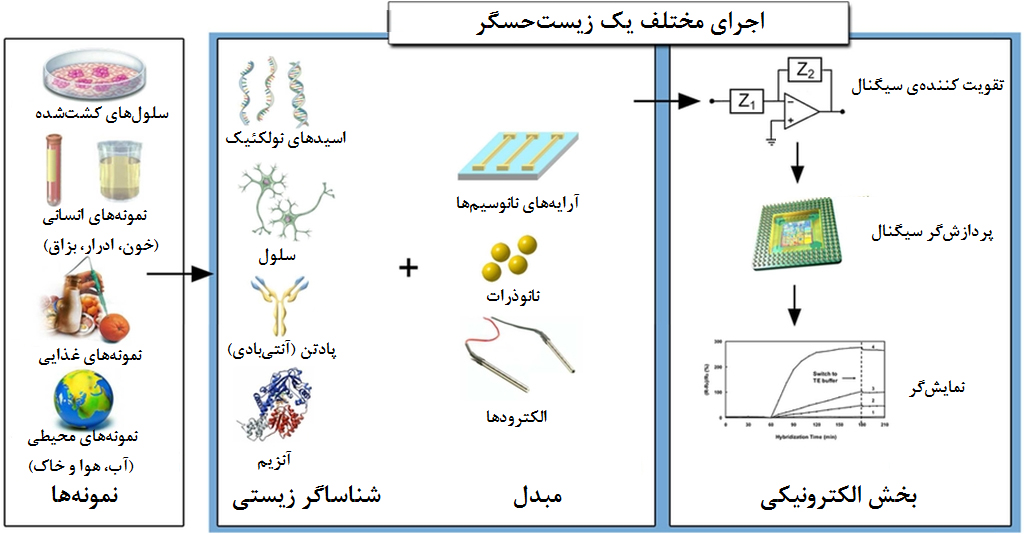
شکل ۱- انواع نمونهها و مولکولهای زیستی مورد استفاده در حسگرهای زیستی
یکی از اولین و البته پرکاربردترین حسگرهای زیستی، الکترودهای آنزیمی برای سنجش سطح گلوکز خون بودند که به دستگاه قند خون معروف شدهاند. گلوکز در بدن به وسیله آنزیم گلوکز اکسیداز، اکسید میشود. پس در این حسگر، گلوکز به عنوان آنالیت و آنزیم گلوکز اکسیداز، شناساگر یا گیرنده است.
نانوزیستحسگر، زیستحسگری است که برای افزایش کارایی آن، از نانومواد در طراحی و ساخت بخشهای اصلیاش استفاده شدهاست. معمولاً از انواع نانومواد برای ساخت و بهبود مبدل، که شامل گیرنده و واسط الکتریکی است، استفاده میشود. از جمله پرکاربردترین نانومواد مورداستفاده میتوان به نقاط کوانتومی، نانوذرات فلزی، نانوذرات سیلیکا، فولرن، نانولولههای کربنی، گرافن و نانوسیمها اشاره کرد. ویژگیهای خاص نانومواد باعث میشود که اتصال جزء شناساگر به آنالیت، در جذب نوری، طیف نشری، رفتار پلاسمونهای سطحی، رسانایی، پتانسیل الکتروشیمیایی و دیگر ویژگیهای آنها تغییری ایجاد کند. برای مثال، میتوان عملکرد نانوحسگرهایی را مطالعه کرد که در ساختارشان از نانومواد یک بعدی، از جمله نانوسیمها یا نانولولهها، استفاده شدهاست. نانومواد یک بعدی امکان اتصال به مولکولهای شناساگر مختلفی را دارند. به دلیل خواص سطحی ویژه، اندرکنش شناساگرها با آنالیت باعث تغییر در رسانایی نانومواد میشود. برای نمونه، نانوسیمهای سیلیکونی پوشش دادهشده با بیوتین برای ردیابی پروتئین استرپتاویدین، که نوع خاصی از باکتریها آن را تولید میكند، بسیار حساس است. مثال دیگر کاربرد نانومواد، استفاده از نقاط کوانتومی نیمهرسانا برای شناسایی گاز NO است؛ مقدار نشر نور این نقاط کوانتومی در حضور گاز افزایش مییابد. این افزایش حساسیت باعث آن میشود كه حسگر بتواند مقادیر بسیار کم آنالیت را که در حسگرهای قدیمیتر قابل تشخیص نبود، شناسایی کند؛ حتی در حد یک مولکول! توانایی زياد نانوزیستحسگرها در تشخیص گونههای مختلف با غلظت بسیار كم برای آنها در حوزههای مختلف کاربردهای فراوانی ایجاد میکند. تشخیص زودهنگام انواع بیماریها، آشکارسازی عوامل بیماریزا در محیط، کشف مواد منفجره در سیستمهای امنیتی، یافتن سموم موجود در محصولات غذایی و دارویی و سنجش شاخصهای سلامتی در جریان خون از جمله کاربردهای امروزی نانو زیستحسگرها هستند.
۲-۱- سامانههای ازمایشگاه روی تراشه
یکی از اولین مفاهیمی که با شنیدن نام فناوری نانو به ذهن میرسد، کوچکسازی یا مینیاتوریکردن در ساخت و طراحی سامانههاست. از جمله محصولات کوچکسازیشده بر اساس نگرش موجود در فناوری نانو که بشر تاکنون توانسته است طراحی کند، سامانههای آزمایشگاه روی تراشه (LOC) است. این سامانهها دستگاههایی در اندازۀ بسیار کوچک ولی با کارایی آزمایشگاهی به وسعت چند متر و چند نفر نیروی انسانی هستند که از کنار هم قرار گرفتن اجزای نانومتری ساخته شدهاند. سامانههای آزمایشگاه روی تراشه قادر به انجام دادن چندین فرایند آزمایشگاهی روی نمونهها با مصرف مقدار بسیار اندک نمونه (حتی تا مقادیر پیکولیتر) روی تراشهای کوچکاند (شکل ۲) فناوری سامانههای روی تراشه به سبب اينكه امکان انجامدادن فرایندهایی چون توالییابی DNA، ردیابی مولکولهای مختلف و حتی سنتز مواد را فراهم ميكند، نویدبخش پیشرفتهای فراوانی در طب تشخیصی است.

شکل ۲- نمونه يك آزمایشگاه روی تراشه
فناوریهای ریزسیال و نانوحسگرها پایههای اصلی سامانه آزمایشگاه روی تراشه را تشکیل میدهند. علم و فناوری ریزسیالها، دانش و توانایی کار با مقادیر اندک سیالات (۹-۱۰ تا ۱۸-۱۰ لیتر) به وسیله مجراهای میکرومتری است که در آن هر مجرا مقدار ناچیزی سیال را در خود جا میدهد و انجام پذيرفتن فرایندهای مختلف و مجزا را ممکن میسازد. این سامانهها از تراشههای کوچکی تشکیل شدهاند و براي تشکیل جریان ریزسیالی، لولههایی با قطر میکرومتری روی آنها تعبیه شدهاست. این سامانهها با نیاز به حجم بسیار کمی از نمونه، تولید مقادیر بسیار کم ضایعات و صرفهجویی در وقت و هزینه، بهعنوان حسگر مولکولی و سلولی و همچنین محلی برای واکنشهای شیمیایی در مقیاس کوچک کاربرد دارند؛ برای مثال، از سامانههای حاوی غشاهای نانومتخلخل برای توالییابی DNA استفاده میشود.
۳-۱- ریزارایهها
سامانههایی شامل تعداد زیادی حسگر میکرو یا نانومتری هستند که با نظم مشخصی آرایش یافتهاند. این سامانهها برای تشخیص DNA، پروتئینها، داروها، سایر مولکولها و یا سلولها کاربرد دارند (شکل ۳). فناوری نانو با ایجاد نانوآرایههای متشکل از اجزاي نانومتری که حساسیت تشخیصی بيشتری دارند، موجب افزایش حساسیت و دقت تشخیصی نانوآرایهها نسبت به میکروآرایههای موجود میشوند. بهعبارتی، با پیشرفت فناوری نانو، میکروآرایهها درحال تبدیلشدن به نانوآرایهها هستند.
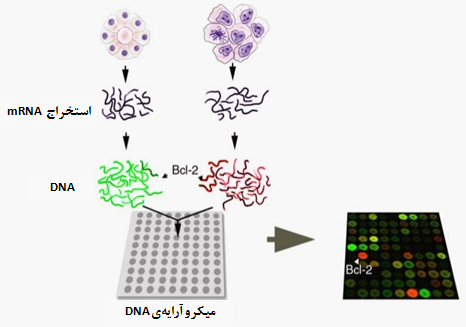
شکل ۳- طرحی از میکروآرایه DNA که ژن مخصوصی بهنام Bcl-2 را در سلولهای سرطانی تشخیص دادهاست.
۴-۱- روشهای تصویربرداری پزشکی
در بسیاری از موارد، هدف تصویربرداریهای پزشکی تشخیص بیماری در مراحل اولیه و غیرپیشرفته است تا موفقیت درمانی افزایش یابد. از دیگر اهداف تصویربرداری، بررسی میزان پیشرفت بیماری یا میزان اثرگذاری درمان بر محدودشدن آن است. برای مثال، درصورتی که مدتی پس از شروع درمان سرطان ریه در تصویربرداری قفسه سینه مشاهده شود که اندازۀ توده سرطانی درمقایسه با قبل از درمان افزایش یافته، میتوان نتیجه گرفت که احتمالاً درمان بیماری مؤثر واقع نشدهاست.
امروزه براي دستیابی بهتر به اهداف مطرحشده، عملکرد بسیاری از روشهای تصویربرداری پزشکی به کمک فناوری نانو بهبود یافتهاست. یکی از جدیدترین پیشرفتها در این زمینه، استفاده از مولکولهای مکمل نشانگرهاي زیستی برای تشخیص دقیق محل بیماری است. نشانگرهای زیستی مولکول یا بخشی از یک مولکول هستند که نشانهای از وجود نوعی سلول خاص یا وضعیتي خاص درون بدن بهشمار میروند. برای مثال، هر نوع سرطان نشانگرهای خاصی دارد که سلولهای سرطانی آن را تولید ميكنند. اين نشانگرها در محل توده سرطانی تجمع مییابند و میتوانند وارد خون نیز بشوند. مثلاً در خون فردی که به سرطان پانکراس مبتلا شدهاست، نشانگري به نام CA19-9 افزایش مییابد؛ پس با سنجش مقدار این نشانگر در خون افراد میتوان این بیماری را پایش كرد.
از دیگر پیشرفتهای تصویربرداری تشخیصی، بهبود تباین یا کنتراست تصاویرِ به دست آمده از دستگاه تشخیصی با استفاده از نانومواد است. تباین تصویر به معنای تفاوت شدت رنگ در نقاط مجاور يكديگر در تصویر است و افزایش آن موجب تفکیک بهتر اجزاي تصویر از هم میشود (شکل ۴) برای مثال، در رادیوگرافی پرتو ایکس از قفسه سینه، بخشهای حاوی هوا بهدلیل جذب کمترِ پرتوها در تصویر به رنگ سیاه دیده میشوند؛ درحالیکه بافتهای استخوانی دندهها به دلیل جذب بيشتر امواج، در تصویر به رنگ سفید مشاهده میشوند. استفاده از نانوموادی که جذب بافتهای بیمار شدهاند، موجب افزایش تباین تصویر بین بافت سالم و ضایعات بیماری میشود. برای مثال، نانوذرات پرفلوئوروکربن به عنوان مواد تشدیدکننده تباین تصویر در تصویربرداریهای هستهای و MRI ونيز تصویربرداریهای مربوط به رگهای خونی كاربرد دارند.

شکل ۴- دو تصویر از یک نمونه با تباین متفاوت
همچنین، از نانوذرات سیلیکونی و فولرینهایی که فضای درون آنها از نانوذرات کوچکتر پر شدهاست و نيز از نانوذرات مغناطیسی برای بهبود تباین و کیفیت تصویر در MRI استفاده ميشود (شکل ۵).
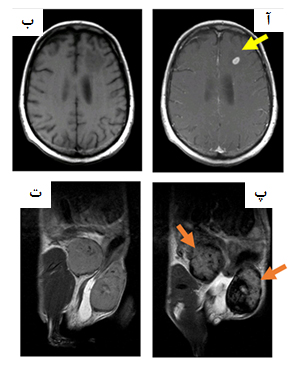
شکل ۵- مثالهایی از کاربرد مواد بهبوددهنده تباین در تصویربرداری MRI؛ (آ) پس از تزریق گادولینیوم، (ب) قبل از تزریق گادولینیوم، (پ)، پس از تزریق نانوذرات سوپرپارامغناطیس اکسید آهن، (ت) قبل از تزریق نانوذرات سوپرپارامغناطیس اکسید آهن
در رادیوگرافی پرتو ایکس باید مقادیر زیادی اتمهای سنگین را بهعنوان ماده ایجادکننده تباین وارد بافت کرد و سپس تصویربرداری را انجام داد. این مواد باید شامل اتمهای سنگین، پایدار، مقرون بهصرفه، غیرسمی و بیخطر باشند. نانوذرات به دلیل چگالی اتمهای سطحی، بيشتر در بهبود کیفیت تصویربرداری مؤثرترند اما مشکل اساسی این نانوذرات، پایداری کمِ آنهاست. البته برخی از نانوذرات سنگین و پایدار مانند طلا و نقره وجود دارند که اگر بخواهیم از آنها استفاده کنیم، هزينه تصویربرداری افزایش مییابد و مقرونبهصرفه نخواهد بود. راهحل پیشنهادی، استفاده از کپسول نانوذرات سنگین با پوسته طلاست كه تمام ویژگیهای مورد نظر ما را داشتهباشد. از طرفی، با این روش میتوان پادتنهای خاصی را که به پادگنهای موجود در بافت مورد نظر ما متصل میشوند، در سطح این نانوساختارها قرار داد تا با تجمع در محل مورد نظر، تصویر باکیفیتتری از این ناحیه ایجاد کنند.
۲- فناوری نانو در درمان بیماری ها
فناوری نانو با بهبود کیفیت روشهای آزمایشگاهی و تصویربرداری تشخیصی میتواند دريچههاي تازهای در تشخیص زودهنگام بیماریهای صعبالعلاج، مانند سرطان، و درمان بهتر این بیماران بهروی ما بگشايد.
۱-۲- دارورسانی هدفمند
فردی با علائم بیاشتهایی و کاهش وزن ناخواسته از سه ماه پیش، با تشخیص سرطان رودۀ بزرگ تحت شیمیدرمانی قرار گرفتهاست. طی فرایند درمان، آزمایش خون بیمار نشان ميدهد که تعداد گلبولهای سفید و قرمز از مقادیر طبیعی خود کمتر شدهاست. از طرفی، بیمار دچار مشکلات گوارشی و ریزش مو شدهاست. این موارد از بارزترین عوارض داروهای شیمیدرمانی است که در اثر تخریب سلولهای سالم بدن توسط این داروها ایجاد میشود. در این میان، روشهای درمانی مختلف با هدف کاهش اینگونه عوارض مورد مطالعه و بهرهبرداری قرار ميگيرند. در میان این روشها، استفاده از نانوزیست فناوری و روشهایی که برای طراحی و سنتز نانوداروهای کارآمد ارائه میکند، به نتایج نویدبخشی منجر شدهاست. در این بخش، ابتدا مفاهیم پایۀ دارورسانی و سپس کاربرد فناوری نانو در این زمینه بررسی میشود.
۱-۱-۲- مسیرهای دارورسانی
یکی از مفاهیم مطرح در دارورسانی، مسیر تجویز دارو است که براساس نوع بیماری و نوع دارو میتواند بهصورت موضعی یا سیستمیک مورد استفاده قرار گیرد. از داروهای موضعی، از جمله پمادهای پوستی، صرفاً در محل بیماری استفاده میشود. این داروها تأثیرات کمتری بر سلولهای سالم در سایر نقاط بدن دارند؛ درحالیکه داروهای سیستمیک، از جمله تزریقی و خوراکی، در خون پخش میشوند و میتوانند بر تمام بدن مؤثر باشند (شکل ۶). در مثال شیمیدرمانی که در بالا مطرح شد، داروهای تزریقی در تمام بدن پخش میشوند؛ درنتیجه، بخش زیادی از دارو به جای بافت سرطانی، بر بافتهای سالم اثر میگذارد و همین امر بازده درمان را کاهش میدهد. از طرفی، به دلیل تأثیرگذاری بر بافتهای سالم و تخریب آنها، عوارض جانبی دارو افزایش مییابد. همانگونه که در شکل (۶) نیز مشاهده میکنید، متداولترین مسیرهای دارورسانی عبارتند از: گوارشی، تزریقی، استنشاقی، پوستی.
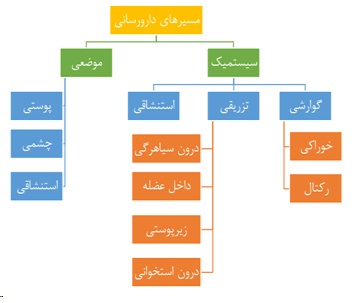
شکل ۶- تقسیمبندی انواع مسیرهای دارورسانی
نکتۀ مهم در اثربخشی همه این داروها، رسیدن غلظت دارو به محدودهای است که بتواند بر بافت هدف اثربخشی کافی داشتهباشد. به این محدوده از غلظت مؤثر دارو، پنجرۀ درمانی گفته میشود. طبق شکل ۷، در صورتی که غلظت دارو در بافت هدف از این محدوده کمتر باشد، اثربخشی کافی نخواهد داشت و بیماری درمان نمیشود اما اگر غلظت دارو از این محدوده بيشتر باشد، تأثیرات سمی و مخرب بر تأثيرات درمانی غلبه خواهد داشت. بر این اساس، متوجه میشویم که چرا هر دارو باید به مقدار مشخص و به تعداد دفعات معینی در شبانهروز مصرف گردد تا موجب بهبود بیماری شود.
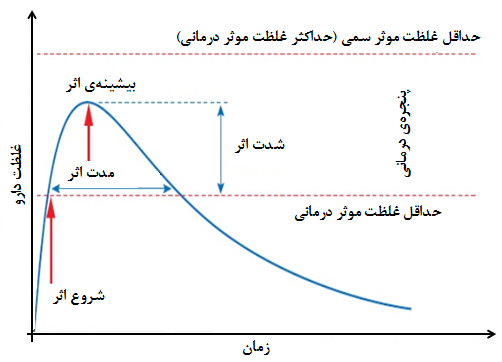
شکل ۷- نمودار تغییرات غلظت دارو – زمان؛ دارو پس از رسیدن به غلظت کافی در پنجرۀ درمانی اثربخش است.
بر اساس مطالبی که در بالا بیان شد، اهداف دارورسانی به طور خلاصه شامل موارد زیر است:
۱. افزایش تأثيرات درمانی دارو
۲. کاهش عوارض ناخواستۀ دارو
۳. آزادسازی دقیق دارو در بافت هدف و کاهش تأثير دارو بر بافتهای سالم
از طرفی، در زمينه کاربرد داروها مشکلاتی مانند جذب کم برخی داروها به خون، انحلالناپذیری برخی داروها در خون و فراهمی زیستی اندک برخی داروها وجود دارد. برای رسیدن به این اهداف و حل مشکلات مطرح شده، تلاشهای گستردهای صورت گرفتهاست که یکی از آنها، کاربرد فناوری نانو و نانوزیستفناوری در دارورسانی است که با عنوان نانودارورسانی شناخته میشود. با توجه به اینکه در این روشهای دارورسانی، معمولاً دارو بهصورت هدفمند و انتخابی به بافتهای هدف میرسد، به این روشها دارورسانی هدفمند نیز میگویند.
نانودارورسانی به طور کلی شامل رساندن کنترلشده و دقیق دارو به بافت هدف به کمک حاملهای نانومتری است. داروها میتوانند درون ساختار یا بر سطح نانوحاملها قرار گیرند و با غلظت درمانی مناسب در بافت هدف آزاد شوند. این روش موجب افزایش کارایی و کاهش میزان سمیبودن و عوارض جانبی داروها میشود.
۲-۱-۲- انواع نانوحاملها در دارورسانی هدفمند
انواع نانوحاملهای مورد استفاده در دارورسانی هدفمند و فرایند کلی بارگذاری دارو در شکل ۸ نشان داده شدهاست.
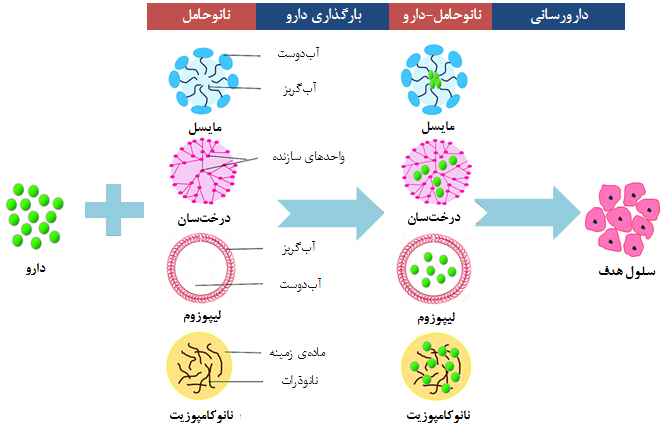
شکل۸- انواعی از نانوحاملها و فرایند کلی بارگذاری دارو درون آنها
لیپوزوم: لیپوزومها، وزیکولهایی متشکل از دو یا چند لایه فسفولیپید هستند که فضای آبی مرکزی را احاطه کردهاند. ضخامت دولایۀ فسفولیپیدی حدود ۳ تا ۶ نانومتر است و قطر لیپوزومهای متشکل از آنها ممکن است بین ۵۰ نانومتر تا ۵۰ میکرومتر باشد. واحدهای تشکیلدهندۀ لیپوزوم، مولکولهایی دوگانهدوستاند؛ به این معنی که یک سر قطبی حاوی گروه عاملی فسفات با خاصیت آبدوستی و یک دم غیرقطبی با خاصیت آبگریزی دارند. شباهت ساختاری لیپوزومها با غشای سلولی این است که هر دو از واحدهای فسفولیپیدی دوگانهدوست تشکیل شدهاند. از جمله تفاوتهای این دو ساختار نیز میتوان به وجود پروتئینهای ویژه در غشای سلول جهت انتشار و انتقال مواد به داخل یا خارج سلول اشاره کرد.لیپوزومها به سبب ساختار دوگانهدوست خود، امکان بارگذاری و حمل داروهای آبدوست، آبگریز و یا دوگانهدوست را دارند.
مایسل: مایسلها حاصل تجمع مولکولهای دوگانهدوست فسفولیپیدی به صورت تکلایه هستند. در صورتی که سرهای آبدوست به سمت محیط و دمهای قطبی به سمت مرکز ساختار قرار گیرند، مایسل عادی تشکیل میشود؛ درحالی که اگر سرهای آبدوست به سمت مرکز و دمهای قطبی به سمت محیط ساختار قرار گیرند، ساختار حاصل، مایسل معکوس نامیده میشود (شکل ۹). مایسلها در غلظت مشخصی از مولکولهای دوگانهدوست تشکیل میشوند.
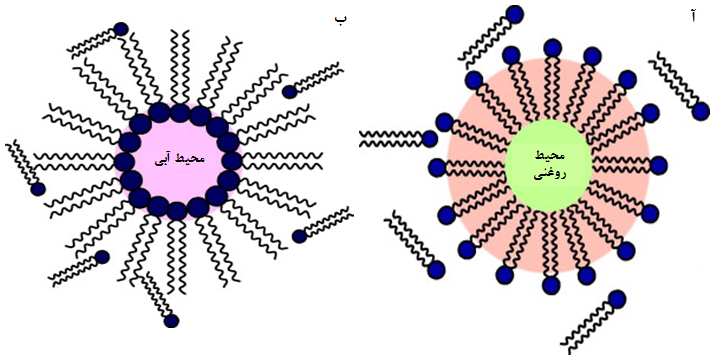
شکل ۹- (آ) مایسل و (ب) مایسل معکوس
نانوذرات لیپیدی جامد: این نانوذرات از ذرات لیپیدی جامد تشکیل میشوند که در محیط آبی، پراکنده و توسط عوامل فعال سطحی پایدار شدهاند (شکل ۱۰). از این نانوذرات در دارورسانی هدفمند استفاده میشود؛ به این ترتیب که دارو همزمان با فرایند سنتز نانوذرات به ترکیب آن اضافه میشود و حاملهایی با هسته یا پوسته غنی از دارو به وجود میآید (شکل ۱۱). این نانوحاملها پس از ورود به بدن با آنزیمهای مختلف، از جمله لیپاز، روبهرو میشوند. لیپاز میتواند ساختار لیپیدی این نانوحاملها را بهتدریج تجزیه کند. سرعت این فرایند به عواملی مانند نوع لیپید و اندازۀ آن وابسته است. تاکنون به کمک این نانوحاملها تحقیقات گستردهای در بارۀ ساخت داروهای موضعی، تزریقی و خوراکی انجام گرفته و پیشرفتهای زیادی نیز حاصل آمدهاست.
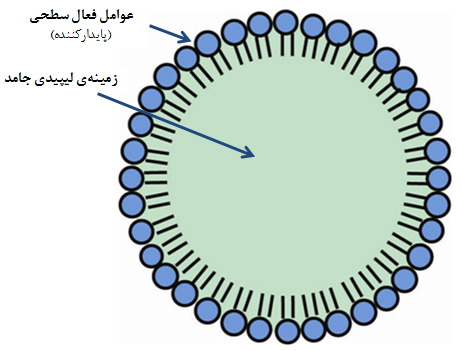
شکل ۱۰- طرحی از ساختار نانوذرات لیپیدی جامد
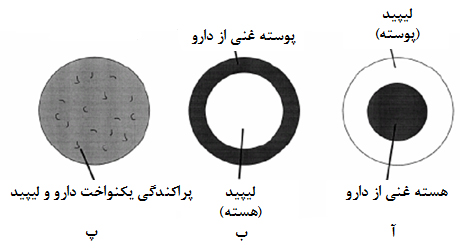
شکل ۱۱- (آ) بارگذاری دارو در نانوذرات لیپیدی جامد به عنوان نانوحامل؛ بارگذاری دارو درون هستۀ نانوحامل، (ب) بارگذاری دارو بر روی پوسته نانوحامل و (پ) پراکندگی یکنواخت دارو در زمينه لیپیدی جامد
نانوذرات مغناطیسی: نانوذرات مغناطیسی به شکل نانوذرات منفرد یا تجمعی از نانوذرات و اغلب از جنس ترکیبات آهن، نیکل و یا کبالتاند و به عنوان نانوحامل در دارورسانی مورد استفاده قرار میگیرند. این نانوذرات اغلب خاصیت سوپرپارامغناطیس، فرومغناطیس یا فری مغناطیس دارند.
مهمترین ویژگی نانوحاملهای مغناطیسی، امکان کنترل آنها از خارج از بدن با اعمال میدان مغناطیسی خارجی است؛ بهگونهای که بتوان دارو را با اعمال میدان مغناطیسی از خارج از بدن، دقیقاً به محل بیماری هدایت کرد. به این نوع رساندن هدفمند دارو، هدفیابی دارو با مغناطیس گفته میشود.
درختسان: درختسانها یا دندریمرها مولکولهای صفربعدی منشعبی در ابعاد نانو هستند که از یک هستۀ مرکزی تشکیل شدهاند و شاخههای جانبی تکرارشونده به صورت مرحلهبهمرحله مشابه شاخههای درخت از آنها منشعب میشوند (شکل ۱۲).
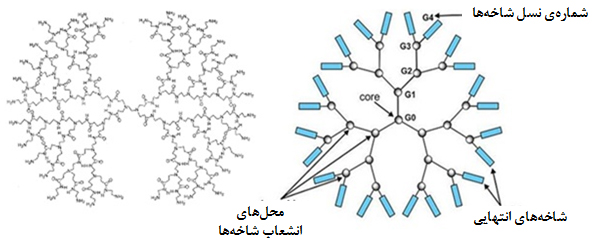
شکل ۱۲- ساختار درختسانها
درختسانها میتوانند مولکولهای مختلف را با توجه به اندازه، خواص سطحیو گروههای عاملی موجود در سطح شاخهها، به خود متصل کنند و مانع تخریب مولکولها توسط عوامل خارجی شوند. همچنین، میتوانند در شرایط محیطی خاصی مولکولهای متصل به خود را آزاد کنند. همین ویژگیها موجب شدهاست که از درختسانها نیز بتوان بهعنوان نانوحامل داروها در دارورسانی هدفمند استفاده کرد.
بهطور کلی، داروها به دو روش میتوانند به درختسان متصل شوند. روش اول، محبوس شدن فیزیکی دارو درون درختسان است؛ بهاین صورت که دارو با برهمکنشهای غیرکووالانسی مانند نیروهای آبگریز، پیوندهای هیدروژنی یا نیروهای الکتروستاتیک به درختسان متصل میشود (شکل ۱۳). برای مثال، اتصال داروی آبگریز به هستۀ درختسان از نوع محبوس شدن فیزیکی داروست. روش دوم به صورت اتصال شیمیایی دارو به گروههای عاملی سطحی درختسان است. برخی از این اتصالات شیمیایی به تغییرات pH حساساند؛ برای مثال، دارویی که در pH طبیعی خون به درختسان متصل است، پس از ورود به اطراف توده سرطانی، که شرایط اسیدی دارد، بهدلیل تغییر pH دارو را در آن محل آزاد میکند.
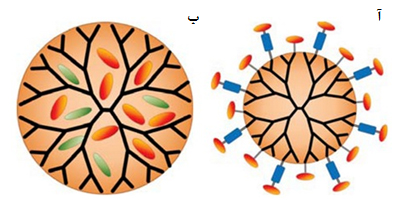
شکل ۱۳- روشهای بارگذاری دارو در درختسان؛ (آ) اتصال شیمیایی دارو به گروههای عاملی سطحی درختسان، (ب) محبوسشدن فیزیکی دارو درون درختسان
نانولولهها: انواع نانولولهها، بهخصوص نانولولههای کربنی و نانولولههای تیتانیوم دیاکسید، قابلیت خود را به عنوان نانوحامل در نانودارورسانی اثبات کردهاند. نانولولههای کربنی به عنوان نانوحامل داروها، ویژگیهای منحصربهفردی دارند؛ از جمله برداشت آسان توسط سلولهای هدف و امکان بارگذاری مقادیر زیاد دارو درون نانولوله. علاوه بر این، امکان عاملدار کردن سطح نانولولههای کربنی از طریق تشکیل پیوند کووالانسی، این امکان را فراهم میکند كه بتوان انواع مولکولهای زیستی و داروها را نیز بر سطح آنها تثبیت کرد.
بسپارها: بسپارها با تنوع بسیار زیاد خود و توانایی اتصال به مولکولهای مختلف، به شکل نانوذرۀ بسپاری، نانوکره، نانوکپسول و غیره بهعنوان نانوحامل در دارورسانی هدفمند کاربرد دارند. برخی از نانوذرات بسپاری توانایی عبور از سد خونی-مغزی را دارند و امکان دارورسانی به مغز را فراهم میکنند. بسپارهای هوشمند که نسبت به تغییرات محیطی دما، رطوبت، pH و غیره حساساند، برای دارورسانی به بافتهایی که شرایط محیطی خاصی دارند مناسب هستند. بسپارها همچنین امکان اتصال به پادتنها و پادگنهای مختلف و دارورسانی اختصاصی به بافتهای هدف را دارند.
ویروزوم: ویروس قطعهای از اسیدنوکلئیک است که توسط پوششی پروتئینی به نام کپسید احاطه شدهاست. ویروسها از نظر زیستی زنده محسوب نمیشوند و مرز بین دنیای زنده و غیرزنده هستند. قطر آنها از حدود ۲۰ تا ۴۵۰ نانومتر متغیر است. ویروسها آنزیمهای لازم برای رشد را ندارند؛ بنابراین، برای تولید مثل باید به سلولهای زنده (جانوری، گیاهی، باکتریایی) متصل و وارد آنها شوند تا از امکانات آنها برای تکثیر خود استفاده کنند. بر همین اساس، ایدۀ استفاده از ویروسها بهعنوان نانوحامل داروها مطرح شد. در این فرایند، دارو درون ویروس بارگذاری میگردد و همزمان با اتصال ویروس به سلول هدف، دارو نیز وارد سلول میشود (شکل ۱۴). به این نانوحاملهای ویروسی، ویروزوم میگویند.
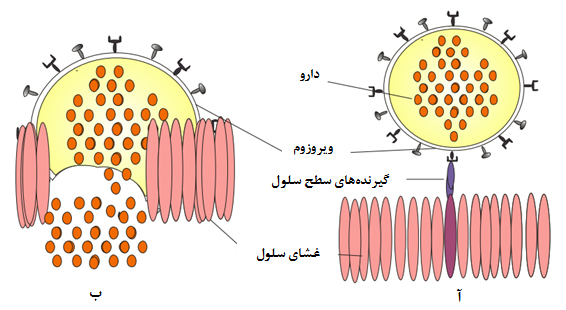
شکل ۱۴- ویروزوم به عنوان نانوحامل در دارورسانی هدفمند؛ (آ) اتصال ویروزوم حامل دارو به سطح سلول هدف و (ب) ادغام ویروزوم با غشای سلول هدف و رهاسازی دارو به درون سلول
فرایند بارگذاری دارو در ویروس به این صورت است که ابتدا کپسید ویروس، ساختار خود را از دست میدهد و اسیدنوکلئیک ویروسی از داخل آن خارج میشود. دارو نیز بهطور همزمان وارد میشود و کپسید، آرایش ساختاری خود را باز میيابد.
با توجه به اینکه پوشش خارجی ویروسها از جنس پروتئینهای کپسیدی است، میتوان سطح کپسید را با مولکولهای خاصی (لیگاند) عاملدار کرد و سپس آن را به بافت خاصی از بدن هدایت نمود. بهاین ترتیب، میتوان از نانوحامل ویروسی برای هدفگیری و درمان انواع بیماریها از جمله تودههای سرطانی، عفونتهای میکروبی، بیماریهای مربوط به دستگاه ایمنی و همچنین واکسیناسیون و ژندرمانی استفاده کرد.
۳-۱-۲- انواع دارورسانی هدفمند
همانطور که گفتهشد، در نانودارورسانی از نانوحاملها جهت رساندن دارو به محل دقیق بیماری و با هدف اثربخشی بيشتر و کاهش عوارض ناخواستۀ دارو استفاده میشود. این نانوحاملها به طور کلی به دو روش میتوانند به سلولهای هدف برسند که با عنوان دارورسانی فعال و غیرفعال شناخته میشوند.
دارورسانی فعال اغلب بهمعنای اتصال مولکولهایی با ساختار خاص به سطح حامل دارو و ورود آن به بدن و درنتیجه، اتصال به سلولهای هدف است. سلولهای هدف بر سطح خود مولکولهایی دارند که از نظر ساختاری مکمل مولکولهای سطح نانوحاملاند. در اینجا مولکولهای سطح نانوحامل و مولکولهای سطح سلول هدف شبیه به قفل و کلید به يکدیگر متصل میشوند و اختصاصی عمل میکنند (شکل ۱۵).
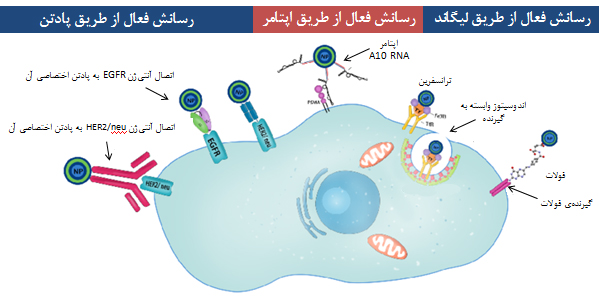
شکل ۱۵- دارورسانی فعال با سه سازوکار استفاده از پادتن، اپتامر یا لیگاند
دارورسانی غیرفعال به معنای تجمع بیشتر دارو در محل بافت هدف به دلیل ویژگیهای خاص بافت هدف است. یک توده سرطانی را درنظر بگیرید؛ این توده شامل سلولهای سرطانی بسیار زیادی است که به دلیل تکثیر زیاد، به خونرسانی بيشتری براي تغذیۀ خود نیاز دارند. بنابراین، در محل توده سرطانی، رگهای خونی بيشتری شکل میگیرند. این رگهای خونی بر خلاف رگهای خونی بافت سالم، در محل توده دیوارهای نسبتاً رخنهدار دارند که موجب نشت مواد با اندازه کوچکتر از رخنهها از رگ به خارج از آن میشود. سلولهای سرطانی با رشد بیرویۀ خود به رگهای لنفاوی نیز حمله میکنند و مسیر خروجی آنها را میبندند (شکل ۱۶). این امر موجب تجمع هرچه بيشتر مواد در محل توده میشود و از خروج آنها جلوگیری میکند. از طرفی، بهدلیل سوختوساز زیاد سلولهای سرطانی، گرمای بيشتری در محل بافت توده تولید میشود و دما در این محل نسبت به بافتهای اطراف، کمی بیشتر است. سوختوساز بيشتر سلولهای سرطانی همچنین موجب افزایش تولید اسیدلاکتیک در محیط بافت میشود و بنابراین، pH بافت سرطانی نیز نسبت به بافتهای سالم کمتر است. این ویژگیهای خاص بافت سرطانی از طریق آزادسازی دارو از نانوحاملهای حساس به دمای بالاتر از بدن و محیط اسیدی و همچنین از طریق افزایش ورود دارو به بافت و کاهش خروج آن، موجب تجمع بيشتر نانودارو در اطراف سلولهای سرطانی میشود و به این ترتیب، اثرگذاری دارو افزایش و عوارض ناخواسته کاهش مییابند. البته این روش در مقایسه با دارورسانی فعال، انتخابگری کمتر و عوارض دارویی بيشتری دارد.
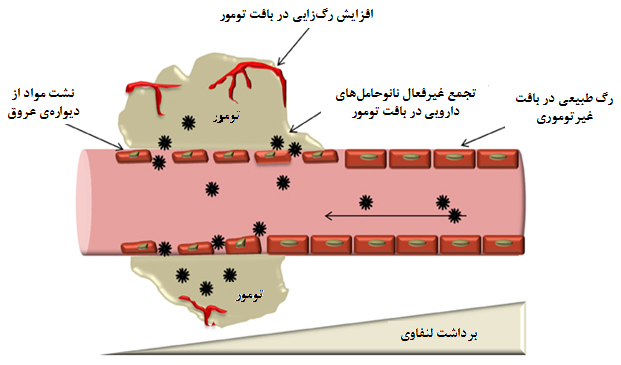
شکل ۱۶- طرحی از دارورسانی غیرفعال به تودۀ سرطانی
۲-۲- نانودارو در درمان بیماریها
تاکنون نانوداروهای بسیار زیادی طراحی شدهاند که بخش اعظم آنها در مرحلة پژوهش و ثبت اختراع باقیماندهاست. تعدادی نیز این مراحل را طی کرده و پس از دریافت تأییدیههای لازم به مرحلة تولید و کاربرد بالینی رسیدهاند.
گزارش سازمان غذا و دارو (FDA)در ایالات متحدة آمریکا با بررسی حدود ۳۵۰ نانودارویی که تا سال ۲۰۱۶ تأییدیۀ این سازمان را کسب کردهاند، نشان میدهد که از نظر کاربرد درمانی، بيشترین کاربرد نانوداروها بهترتیب در درمان سرطان، التهاب، درد و بیماریهای عفونی بودهاست. همچنین، تاکنون گزارشی در بارۀ درمان بیماریهای شایعی مانند دیابت، بیماری فشار خون و بیماریهای قلبی- عروقی توسط نانوداروها وجود ندارد.
از نظر نوع نانوحامل، لیپوزوم، نانوبلورها، امولسیونها، ترکیبات بسپاری و میسلها بهترتیب پرکاربردترین نانوحاملهای داروها بودهاند. نانوساختارهایی مانند نانولولههای کربنی، گرافن و نقاط کوانتومی کاربرد کمتری در نانوداروها داشتهاند.
از نظر مسیر دارورسانی، که به آن اشارهشد، اغلب این نانوداروها از طریق تزریق درونسیاهرگی و بعد از آن به ترتیب از طریق خوراکی، چشمی و روشهای موضعی دیگر تجویز میشوند.
بررسی اندازۀ نانوذرات مورد استفاده در این نانوداروها نشان ميدهد که اغلب از ذرات کوچکتر از ۳۰۰ نانومتر و در تعداد کمی از داروها از ذرات ۳۰۰-۱۰۰۰ نانومتر به عنوان نانوحامل استفاده شدهاست. در مورد اندازۀ معمول ذرات استفاده شده در سنتز نانوداروها باید به این نکتۀ مهم توجه کنید؛ معمولاً در سنتز نانوداروها خواص جدیدی که در سایر حوزههای فناوری نانو در ابعاد کمتر از ۱۰۰ نانومتر ظهور میکنند (مانند پدیدههای اندازه کوانتومی)، جز در مواردی خاص مانند استفاده از نقاط کوانتومی؛ چندان مورد توجه نیستند. لذا شرط ابعاد کاری در محدوده ۱-۱۰۰ نانومتر که بهصورت عمومی برای فناوری نانو تعریف شده است، در مورد نانوداروها مطرح نیست. آنچه در نانوداروها مورد توجه قرار دارد، نخست قابلیت حمل مقدار کافی داروست که موجب افزایش اندازۀ حامل میشود و دوم کنترل دقیق (ابعاد مولکولی) نحوۀ پیوند و قرارگیری مولکولهای زیستی نانوداروست. چنین کنترل دقیقی در ابعاد مولکولی یکی از موارد اصلی تعریف فناوری نانوست که ویژگیهای درمانی منحصر بهفردی به نانوداروها میدهد و موجب کارایی آنها میشود.
۳-۲- نانو واکسنها
واکسن عاملی است که باعث ایجاد مقاومت علیه یک بیماری در بدن میشود. در واقع، واکسن این تصور را به دستگاه ایمنی القا میکند که عامل بیماریزای واقعی به بدن حمله کردهاست و با این کار، آن را به واکنش وامیدارد. در طراحی واکسنهای نسل جدید، فقط بخشی از عامل بیماریزا هدف قرار میگیرد که از طرفی در چرخۀ ایجاد بیماری نقشی مهم دارد و از طرف دیگر، قادر به تحریک دستگاه ایمنی است. این بخش در واقع پادگنی است که میتواند شامل یک یا چند اپیتوپ باشد. نانوواکسنها واکسنهای نسل جدیدی هستند که مواد نانوساختار در ترکیب آنها وجود دارد. این نانوساختارها میتوانند از جنسهای مختلف باشند و نقشهای متفاوتی در ایجاد پاسخ ایمنی مناسب داشتهباشند. هدف نهایی نانوواکسنها ایجاد پاسخ ایمنی هومورال و سلولی به مقدار قابل قبول، افزایش برداشت پادگن توسط سلولهای ایمنی، کاهش دوز مورد نیاز از واکسن و کاهش عوارض جانبی واکسنهاست.
۱-۳-۲- انواع نانوساختارهای استفاده شده در نانوواکسنها
نانوذرات بسپاری: نانوذرات بسپاری از جملۀ پرکاربردترین نانوساختارها در نانوزیستفناوری و به ویژه نانوواکسنها هستند. بسپارها میتوانند نانوساختارهای مختلفی چون نانوذرات و نانوژلها را شکل دهند که ویژگیهای لازم برای استفاده در بدن را دارند. نانوذرات بسپاری مختلفی چون نانوذرات پلیاستایرن در ساخت نانوواکسنها مورد استفاده قرار گرفتهاند که در این میان، نانوذرات PLG و PLGA به دلیل زیستسازگاری و زیستتخریبپذیری زیاد، بيشتر مورد توجه پژوهشگران بودهاند. این نانوذرات پادگنها را درون خود نگه میدارند و به سلولهای هدف میرسانند و در مقایسه با روشهای معمول، به دلیل سرعت کم تخریبشدنشان پادگنها را در مدت طولانیتری رها میسازند. هرکدام از این نانوذرات ویژگیهای خاصی در انتقال پادگنها دارند؛ برای مثال، نانوذرات g-PGA دارای سر آبدوست و دم آبگریز هستند و میتوانند مایسلهای خودآرای نانومتری تشکیل دهند. فضای درون این مایسلها آبگریز است و بنابراین، برای انتقال پادگنهای آبگریز مناسباند. از طرفی، نانوذرات پلیاستایرن میتوانند پادگنهای گوناگونی را انتقال دهند؛ زیرا سطح این نانوذرات را میتوان با مولکولهای مختلف عاملدار کرد.
نانوساختارهای غیرالی: نانوساختارهای غیرآلی مختلفی برای رسانش پادگنها مورد مطالعه قرار گرفتهاند. با وجود اینکه بيشتر این نانوساختارها زیستتخریبپذیر نیستند، نکتۀ مثبت آنها نسبت به دیگر نانوساختارها، امکان سنتزشان در اشکال و اندازههای مختلف و کنترلشده است. نانوذرات طلا از جمله نانوذراتی هستند که در این حوزه کاربردهای فراوانی دارند. یکی از مزایای این نانوذرات، علاوه بر امکان سنتز کنترلشده، توانایی عاملدار شدن آنها با کربوهیدراتهاست.
لیپوزومها: یکی از پرکاربردترین نانوساختارها در نانوزیستفناوری، لیپوزومها هستند و از جمله کاربردهای آنها انتقال پادگن است. لیپوزومها میتوانند پادگنها را در فضای خالی مرکزی خود قرار دهند و منتقل کنند. تاکنون چند سامانه لیپوزومی برای استفاده در انسان تأییدیههای لازم را دریافت کردهاند. برای مثال، واکسن Inflexal®V از لیپوزومهایی با قطر ۱۵۰ نانومتر ساختهشده که پادگنهای ویروس آنفلوآنزا بر سطح آنها قرار گرفتهاست.
نانوذرات شبهویروس: ویروزومها یا نانوذرات شبهویروس از خودآرایی پروتئینهای کپسیدی ساخته شدهاند که اسید نوکلوئیک عامل بیماریزایی را درون خود ندارند. این نانوذرات یکی از مناسبترین ساختارها برای استفاده در نانوواکسنها هستند؛ زیرا ساختارشان به خوبی میتواند پاسخ ایمنی را بدون آثار بیماریزایی، تحریک کند. علاوه بر این، ساختار تکرارشوندۀ کپسیدها در این نانوذرات باعث میشود که برای ایجاد پاسخ ایمنی قابل قبول، به مادۀ کمکی نیاز نداشته باشند؛ زیرا با قدرت مناسبی میتوانند دستگاه ایمنی را فعال کنند. استفاده از نانوذرات شبهویروس به دو صورت است؛ در حالت اول کپسیدهای سازندۀ این نانوذرات، که نقش پادگن را دارند، از ویروس موردنظر استخراج میشوند و با خودآرایی، ساختار نهایی را میسازند. در واقع، پروتئینهای کپسید عامل پاسخ ایمنی هستند اما گاهی هم این نانوذرات، حامل پادگنی هستند که ممکن است به ویروس اولیه ارتباطی نداشته باشد. استفاده از نانوذرات شبهویروس به عنوان یک سامانة رسانشی، توانایی این نانوساختارها را در طراحی نانوواکسنها بیش از پیش آشکار ساخت. امروزه، چندین نانوواکسن مبتنی بر نانوذرات شبهویروسی وارد بازار شدهاند. تعداد زیادی نیز در حال گذراندن مراحل لازم برای گذر از آزمایشگاهها و استفاده در بالین بیماران هستند. با توجه به روندهای موجود، در سالهای آینده نيز بر تعداد این نانوواکسنها افزوده میشود. واکسن Cervarix R نمونهای از این واکسنهاست که ضد ویروس پاپیلوم انسانی (عامل سرطان گردن رحم) است.
امولسیونهای نانومتری: امولسیونها از دیگر نانوساختارهایی هستند که به عنوان مادۀ کمکی در نانوواکسنها کاربرد دارند. امولسیونها میتوانند به دو صورت آب در چربی یا چربی در آب باشند که هر کدام برای شرایط ویژهای کاربرد دارد. این نانوساختارها در ابتدا فقط به عنوان مادۀ کمکی مورد توجه قرار گرفتند اما امروزه از آنها در سامانههای رسانش پادگنها نیز استفاده میشود. امولسیونهاي نانومتري میتوانند پادگنها را درون خود حمل کنند یا اینکه بهسادگی با آنها مخلوط شوند.
نانوذرات مختلفی که در نانوواکسنها مورد استفاده قرار میگیرند، محدودهای از اندازههای مختلف را دارند و همین اندازههای مختلف، یکی از عوامل مهم استفادۀ اختصاصی از نانوذرات برای پادگنهای مختلف است (شکل ۱۷).
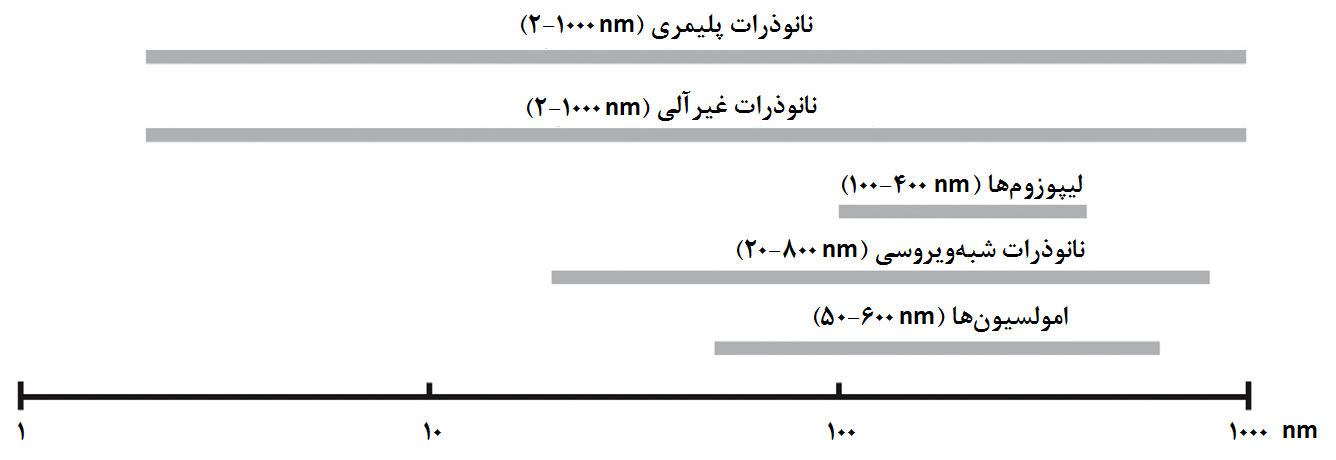
شکل ۱۷- محدوده اندازۀ نانوذرات پرکاربرد در نانوواکسنها
۲-۳-۲- برهمکنش نانوذرات و پادگن
از نانوذرات در واکسنها به دو حالت استفاده میشود؛ در حالت اول، نانوذرات به عنوان یک سامانه رسانش پادگن به دستگاه ایمنی عمل میکنند و در حالت دوم، مسیرهایی از دستگاه ایمنی را فعال میسازندکه در نهایت، پاسخ ایمنی به پادگن را بهبود میبخشند. نانوذرات به عنوان سامانههای رسانش میتوانند به عنوان حامل موقت و عاملی برای محافظت از پادگن عمل کنند و آن را در محیط مناسب رها سازند یا اینکه پادگن را تا آخرین مراحل درون خود نگهدارند؛ به طوری که سلول ایمنی مجموعۀ نانوذره و پادگن را با هم ببلعد.
یکی از مهمترین مراحل طراحی نانوواکسن، برقراری ارتباط میان نانوذره و پادگن است. در حالتی که نانوذره نقش رسانش پادگن را به عهده دارد، پادگن میتواند به صورت جذب فیزیکی یا با یک پیوند شیمیایی به سطح نانوذره متصل شود و یا اینکه نانوذره آن را درون خود جا دهد. جذب سطحی از طریق نیروهای ضعیفی چون جاذبۀ میان بارهای الکتریکی یا برهمکنشهای آبدوستی یا آبگریزی اتفاق میافتد. در این حالت، رهایش پادگن سریعتر از دو حالت دیگر در بدن رخ میدهد. در دو حالت دیگر، یعنی اتصال با پیوند شیمیایی یا کپسولهکردن، اتصال میان نانوذره و پادگن قویتر است و این اجزا زمانی از هم جدا میشوند که سلول ایمنی مجموعۀ آنها را با هم بلعیده و هضم کردهباشد.
اما زمانی که نانوذرات تنها نقش بهبود دهندۀ پاسخ ایمنی را داشتهباشند، علاوه بر سه حالت قبل حالت چهارمی نیز وجود دارد و آن مخلوطسازی پادگن و نانوذره بدون ارتباط آنها باهم است. پژوهشهای انجام شده در این زمینه نشان دادهاست که برای افزایش پاسخ ایمنی، به اتصال میان اجزاي نانوواکسن نیازی نیست و حتی تزریق جداگانۀ این دو جزء میتواند نتایج لازم را به ارمغان آورد. در شکل ۱۸ حالتهای مختلف طراحی نانوواکسن نشان داده شدهاست.
حوزه کاربردهای فناوری نانو در دستگاه ایمنی انسان روزبهروز گستردهتر میشود. پژوهشگران در تلاشاند كه سطح فعالیت دستگاه ایمنی را به کمک نانوساختارها تنطیم کنند. دستیابی به این دانش، توانایی بشر را برای درمان بیماریهایی چون سرطان، بیماریهای خودایمنی و التهابها افزایش میدهد.
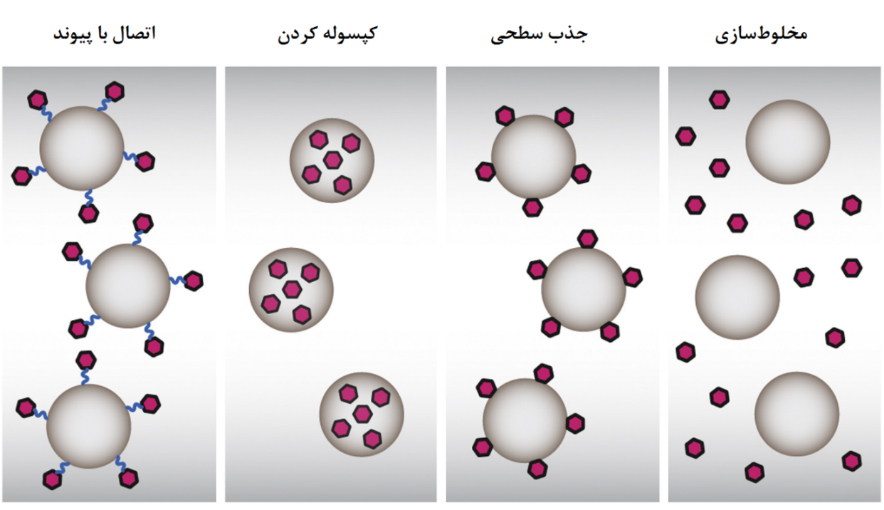
شکل ۱۸- حالتهای مختلف طراحی نانوواکسن

