- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
آنالیز داده های ژنتیکی, اخبار علمی, استخراج DNA, پایان نامه نویسی, دوره آموزشی ژنتیک مولکولی, دوره جامع آزمایشگاه ژنتیک, دوره کارآموزی سیتوژنتیک وکاریوتایپ, دوره کارآموزی مهندسی ژنتیک مقدماتی, مقاله نویسی
مکانیسم بیان ژن
بیان ژن
بیان ژن فرایندی است که در آن اطلاعات درون ژن استفاده میشود تا یک محصول کاربردی از آن بدست آید. محصول ژنها عمدتاً آمینواسیدی هستند و از محصولات غیر آمینو اسیدی میتوان به rRNA ،tRNA ،sRNAو mRNA اشاره کرد. فرایند بیان ژن به وسیله تمام یوکاریوتها و پروکاریوتها (باکتریها و..) انجام مى شود. مراحل مختلفی را میتوان برای فرایند بیان ژن در نظر گرفت که عموماً شامل رونویسی، ترجمه و تغییرات بعد از ترجمه یک پروتئین میباشد. تنظیم بیان ژن به سلول این امکان را میدهد تا بتواند ساختار و کاربرد خود را کنترل کند و این مسئله پایهای است برای تفاوتهای سلولی (تمایز)، دگرگونی (تکامل) و مهارت تطبیق ارگانیسمها با شرایط جدید. از آنجا که تمام سلولهای بدن انسان از یک سلول مشتق شدهاند تفاوتها و تمایزات بین سلولها حاصل از بیان شدن یا نشدن قسمتهایی از ژن است. بیان ژن همچنان میتواند به عنوان یکی از زیر لایههای تکامل در نظر گرفته شود زیرا کنترل زمان بندی، مکان و مقدار ژن میتواند تأثیرات مهمی در عملکرد ژنها درون سلول یا کل ارگانیسم پرسلولی داشته باشد. درعلم ژنتیک، بیان ژن یکی از مهمترین مسائل بنیادی است که کمک میکند تا ژنوتیپ به صورت فنوتیپ ظاهر شود. در واقع کدهای ژنتیکی که در رشتههای DNA ذخیره شدهاند به وسیله بیان ژن تفسیر میشوند و خصوصیات و نحوه بیان ژن باعث به وجود آمدن فنوتیپ در ارگانیسم خواهد شد.
مکانیزم
ژنها توالیهای کشیده شدهای از DNA است که اطلاعات ژنتیکی را در خود نگهداری میکند که به وسیله کدهای ژنتیکی ذخیره شدهاند. هر مولکول DNA شامل دو رشته است که هر کدام دو سر ۳’، ۵’ دارند. مناطق کدینگ شامل اطلاعات ژنتیکی هستند و قسمتهای که اطلاعات ژنتیکی ندارند در تولید RNAها کمک میکنند. تولید یک کپی RNA از روی DNA را مرحله رونویسی می نامیم، این فرایند به وسیلهٔ RNA polymerase انجام میشود که در هر لحظه یک نوکلئوتید RNA را به رشتهٔ RNA در حال تولید، اضافه میکند. رشتهٔ RNA تولید شده مکمل رشتهٔ DNA ایست که از روی آن رونویسی انجام شده تنها با این تفاوت که در آن در مقابل باز آدنین (A)، به جای تیمین (T) از یوراسیل (U) استفاده میشود. عمل رونویسی در پروکاریوتها به وسیله یک پلیمراز انجام میشود اما در یوکاریوتها این عمل به وسیله سه RNA پلی مراز مختلف صورت میگیرد که پلی مراز اول برای رونویسی ژن های rRNA است و پلی مراز دوم برای رونویسی ژن های mRNA و برخی RNA های کوچک استفاده میشود و پلیمراز سوم در رونویسی ژن های tRNA و برخی RNA های کوچک کاربرد دارد. عمل رونویسی پس از رسیدن به یک توالی مشخص(توالی پایان)خاتمه می یابد.
پردازش RNA
در پروکاریوتها محصول مستقیم رونویسی از روی ژنهایی که محصول آنها پروتئین است، mRNA است اما در یوکاریوتها ابتدا یک pre-mRNA ساخته میشود که پس از انجام یکسری عملیات به mRNA تبدیل خواهد شد. در این فرایند تبدیل بخشهایی از pre-mRNA که حاوی اطلاعات نیستند (اینترون)حذف میشوند و آن نواحی دارای اطلاعات ژنتیکی هستند(اگزون) به هم متصل میشوند تا mRNA نهایی به دست آید.
خارج شدن RNA از هسته
در یوکاریوتها بیشتر RNAها باید از هسته خارج شوند و به محیط سیتوپلاسم وارد شوند که تمام RNAهایی که محصول نهایی آنها پروتئین است از این دسته میباشند. گاهی نیز برخی از RNAها باید به محلهای خاصی از سیتوپلاسم منتقل شوند مانند سیناپسها.
ترجمه
برای برخی از ژنها محصول نهایی همان RNA ای است که در مراحل قبل تولید شده، اما برای بسیاری مانند mRNAها این آخرین مرحله نیست. mRNAها همراه خود کد یک یا چند توالی پروتئین را حمل میکنند. در هر توالی mRNA اطلاعات ژنتیکی به وسیلهٔ کدهای سه تایی به نام کدون (codon) که پشت سرهم قرار دارند ذخیره شدهاست. در فضای سیتوپلاسم برای هر کدام از این کودونها یک tRNA با یک سهتایی مکمل وجود دارد که همراه خود آمینو اسید مشخصی را حمل میکند. سپس این آمینواسیدها به وسیله یک رناتن و همچنین ترتیب کدونها بر روی mRNA به هم متصل میشوند و توالی پروتئینی به دست میآید. از روی هر رشتهٔ mRNA میتوان تعداد زیادی توالی پروتئین ساخت.
مکانیسم های تنظیم بیان ژن
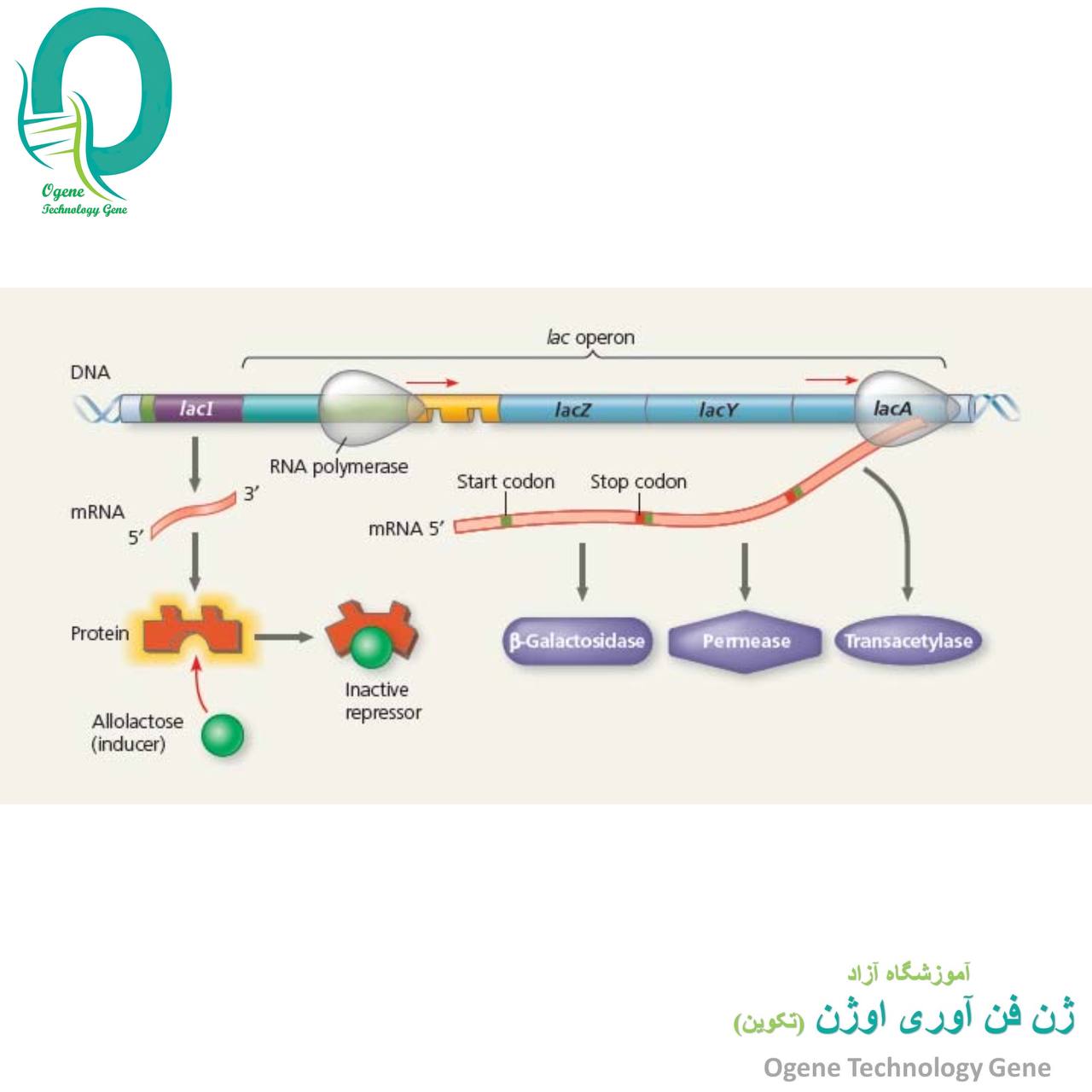
تنظیم بیان ژن در پروکاریوت ها
- مکانیسم تضعیف:
نیاز به همزمانی ترجمه با رونویسی دارد لذا تنها در پروکاریوت ها دیده می شود. در ابتدایmRNA یک توالی رهبر با 162 نوکلئوتید وجود دارد که به سه قطعه 1، 2، 3 و 4 تقسیم می شود. قطعه 1حاوی دو کدون تریپتوفان است و توالی های 2 با 3 و 3 با 4 می توانند جفت شده و ایجاد سنجاق کنند. در حضور Trpترجمه قطعه 1 بدون وقفه انجام شده و در هنگام رونویسی قطعه 3ریبوزوم بر روی قطعه 2 قرار می گیرد. لذا امکان ایجاد سنجاق 2 و 3 وجود نداشته و قطعه 3 با 4 ایجاد سنجاق می کند که همانند پیام خاتمه رونویسی عمل می نماید. در غیاب Trpریبوزوم در قطعه 1 متوقف شده و با ایجاد سنجاق 2 و 3 پیام خاتمه حاصل از جفت شدن 3 و 4 ایجاد نمی گردد. پس رونویسی ادامه یافته تا آنزیم های سنتز کننده تریپتوفان تولید گردند. مکانیسم تضعیف جهت کنترل بیان اپرون اسیدهای آمینه دیگر نظیر لوسین، هیستیدین و فنیل آلانین نیز کاربرد دارد.
- تنظیم هماهنگ ژن ها:
سیسترون توالی از یک ژن است که یک پلی پپتید را کد می کند. تمامی mRNA های یوکاریوتی از نوع منوسیسترونی (تک ژنی) هستند، یعنی تنها حاوی اطلاعاتی برای ساخت یک زنجیر پلی پپتیدی می باشند. mRNA های پروکاریوتی اغلب از نوع چند ژنی (پلی سیسترونی) بوده که بیش از یک زنجیر پلی پپتیدی را کد می کنند. رونویسی ژن های پلی سیسترونی تحت کنترل یک پروموتر قرار دارد، ولی ترجمه هر توالی سیسترونی در مولکول mRNA مستقل می باشد. جهش قطبی (Polar Mutation) که اغلب در توالی های فرادست یک ژن ایجاد می شود، می توانند بر بیان ژن ها یا اپرون های فرودست تاثیر بگذارد. این نوع جهش ها می توانند از نوع بی معنی، تغییر چارچوب و یا اضافه شدن باشند و تنها در موجودات دارای mRNA پلی سیسترونی یافت می شوند.
تنظیم بیان ژن در یوکاریوت ها
- متیلاسیون DNA:
5-متیلاسیون ریشه های سیتوزین در توالی های CpG در DNA یوکاریوتی اغلب همراه با کاهش بیان ژن همراه است. در برخی سرطان ها هیپرمتیلاسیون DNA در ناحیه پروموتر ژن های سرکوب کننده توموری یافت می شود. متیلاسیونDNA با واسطه DNA متیل ترانسفراز (DNMT) توسط 5-آزاسیتیدین و آنالوگ های نوکلئوزیدی وابسته مهار می شود.
- تغییرات هیستون ها:
هیستون هایH3 و H4 متحمل استیلاسیون برگشت پذیر وابسته به چرخه سلولی می شوند که توسط آنزیم هیستون استیلاز و هیستون داستیلاز بر روی گروه آمینو زنجیره جانبی اسید آمینه لیزین صورت می گیرد. در واکنش استیلاسیون گروه های استیل از استیل-کوآ به هیستون ها به ویژه گروه های N-ترمینال هیستونH3 و H4منتقل می شوند. استیلاسیون هیستون ها توسط هیستون استیل ترانسفرازها (HATs) نظیرp300 و CBP (پروتئین اتصالیCREB ) باعث کاهش میزان بار خالص هیستون ها شده و تعامل الکتروستاتیک هیستون ها وDNA را ضعیف می کند. این امر منجر به سست شدن ساختار کروماتین و افزایش بیان ژن می شود.
جهش در ژنCBP منجر به سندرم روبنشتین-تای بی می گردد که با عقب ماندگی ذهنی و سایر نقایص تکاملی همراه است. این نقایص به سبب جهش نقطه ای، حذف قطعات کوچک و نوترکیبی در ژنCBP می باشد. داستیلاسیون هیستون ها توسط مهار کننده های هیستون داستیلاز (HDAC) به منظور تحریک مجدد بیان ژن سرکوب شده توموری استفاده شده است. یکی از این نوع مهارکننده ها ورینوستات است که توسط FDAجهت درمان لنفومای سلول T تایید شده است.
استیلاسیون زنجیره های جانبی اسیدهای آمینه بازی (لیزین و آرژینین)، فسفریلاسیون سرین و ترئونین و متیلاسیون لیزین (یک، دو و سه متیل) می تواند در تنظیم فعالیت DNA نوکلئوزومی تاثیر داشته باشد. مثلا استیلاسیون و فسفریلاسیون می تواند بار هسته هیستونی را شدیدا تغییر داده و باعث اتصال ضعیف DNA گردد.
یوبی کوئیتیناسیون و سومولاسیون هیستون ها نیز می تواند فعالیت ژن را تحت تاثیر قرار دهد. یوبی کوئیتین در آرایش و تفکیک کروموزوم ها، ترمیم DNA، تنظیم رونویسی در پاسخ التهابی نیز دخالت دارد. پروتئین های تغییر دهنده وابسته به یوبی کوئیتین کوچک (SUMO) که دارای کنفورماسیون و اتصال با پروتئین های هدف هستند بسیار مشابه یوبی کوئیتین بوده و در تنظیم رونویسی و دیگر جنبه های دیگر رونویسی نقش دارند.
- تنظیم سنتز توبولین:
هنگامی که توبولین در سلول زیاد می شود پروتئین منومری بهmRNA توبولین متصل شده و موجب تخریب آن می شود.
- تنظیم ترجمه به کمک پروتئین 4E:
پروتئین 4E مسئول شناسایی کلاهک mRNA است که یک مرحله محدود کننده سرعت در ترجمه می باشد. این فرآیند در دو حالت قابل تنظیم است. در یک حالت انسولین و فاکتورهای رشد میتوژنیک منجر به فسفریلاسیون پروتئین 4E می شوند 4E فسفریله تمایل بسیار بیشتری برای اتصال به کلاهک دارد و بنابراین سرعت شروع را افزایش می دهد. در یک حالت دیگر برخی پروتئین ها به 4E اتصال یافته و آن را غیر فعال می سازند.
- تنظیم سنتز هم با سنتز گلوبین به کمک eIF-2:
در هر دور طویل سازی سنتز پروتئین فاکتورeIF-2 به شکل متصل به GDP آزاد می شود. جایگزینی GDP باGTP به کمکeIF-2B صورت می پذیرد. در هنگام کمبود آهن یا هم، پروتئین کینازی به نام سرکوبگر تحت کنترل همین (HCR) فعال شده و فسفریلاسیونeIF-2 را کاتالیز می کند. در شکل فسفریله eIF-2 به eIF-2B اتصال یافته و ایجاد کمپلکس پایدار می کند. نتیجه کاهش ترجمه مولکول های mRNA است.
- تنظیم سنتز گیرنده ترانسفرین و فریتین به کمک آهن سلولی:
در هر مولکولmRNA مربوط به فریتین و گیرنده ترانسفرین توالی غیر قابل ترجمه در انتهای 5 وجود دارد که عنصر پاسخ به آهن (IRE) نامیده می شود. این توالی ها با یک پروتئین سیتوزولی به نام پروتئین اتصالی به عنصر پاسخ به آهن تعامل دارند که به میزان آهن سلول حساس است. در مقادیر بالای آهن سلولی این تعامل سبب استفاده mRNA فریتین برای سنتز آن و تخریب mRNA گیرنده ترانسفرین برای کاهش سنتز آن می شود. با کاهش آهن، mRNA گیرنده ترانسفرین پایدار شده و mRNA فریتین ذخیره می شود. آنزیم دلتا آمینولوولینیک اسید سنتاز نیز توسط5-IRE موجود درmRNA خود تنظیم می شود.
- تنظیم فاکتور رونویسی NF-kB:
دو زیر واحد هتروترایمر فاکتور رونویسی NF-kB (P50 و P65) واجد ناحیه مشابهی در ناحیه N-ترمینال خود می باشند که برای دیمریزاسیون آن ها و اتصال به DNA لازم است. در زمانی که که سلول دچار استرس یا پاسخ به عفونت نمی باشد، NF-kB در سیتوزول، با اتصال مستقیم به مهارکننده ای تحت عنوان kB-I، غیر فعال می شود. در مدت چند دقیقه بعد از تحریک سلول توسط یک عامل عفونت زا مانند ویروس، سیتوکین التهابی و یا اشعه یونیزان، kB-I کیناز فعال شده و دو ریشه سرین N-ترمینال را بر روی kB-I فسفریله می کند. سپس یوبی کوئیتین لیگاز E3 به این فسفوسرین ها متصل شده و kB-I را پلی یوبی کوئیتینه نموده و موجب تجزیه آن در پروتئازوم می شود. در سلول های بیان کننده شکل جهش یافته kB-I که این دو سرین به آلانین تغییر کرده اند و لذا نمی توانند فسفریله شوند، NF-kB دائما غیر فعال است.
در حال حاضر RNAمداخله گر (RNAi) بهترین روش جهت بررسی عملکرد ژن ها در ژنتیک معکوس (Reverse genetics) می باشد. نتایج تحقیقات زیادی در این زمینه نشان می دهد که این روش بسیار اختصاصی عمل می کند و راه اندازی چنین سیستمی در قیاس با سایر سیستم های غیر فعال سازی ژنها ساده تر و ارزان تر است.
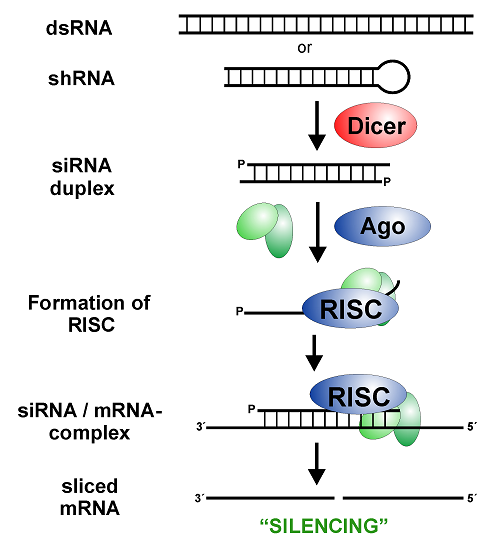
مهم ترین اجرای این مکانیسم عبارتند ازsiRNA ، DICER ، dsRNA و RISC می باشند.
- نقش RNA دو رشته ای (dsRNA) در سیستم RNA مداخله گر (RNAi)
در سیستم RNA مداخله گر (RNAi) القا کننده اصلی خاموشی ژن هدف یک RNA دو رشته ای (dsRNA) می باشد که منابع اصلی آن عبارتند از:
- نسخه برداری ژن های با توالی های معکوس و تولید mRNAهایی که سنس و آنتی سنس یکدیگرند و قابلیت جفت شدن با هم را دارا می باشند.
- رونویسی RNA توسط آنزیم RNA dependent RNA polymerase (یا RdRp) که اگر رونویسی از روی mRNA صورت گیرد رشته آنتی سنس siRNA نقش آغازگر را برای آنزیم بر عهده خواهد داشت اما اگر رونویسی از روی RNA ناقص (Aberrant RNA) که نتیجه شکستن mRNA در فرآیند PTGS است صورت گیرد نیازی به آغازگر وجود ندارد.
- پلاسمید خارجی کدکننده shRNA) ،shRNA یک RNA دو رشته ای می باشد که به عنوان پیش ساز siRNAها مورد استفاده قرار می گیرد.)
- نقش siRNA در سیستم RNA مداخله گر (RNAi)
این القاگرهای RNAi به صورت RNA خطی و دورشته ای جفت شده بوده که به صورت مستقیم به سیتوپلاسم انتقال می یابند یا از محیط جذب سیتوپلاسم می شوند. dsRNA ها به وسیله دایسر جهت تولید siRNAها برش یافته و باعث خاموشی می شوند در آزمایشهایی چندین siRNA از نواحی متفاوت کدون ژن ایجاد شد که هر کدام از لحاظ خاموشی ژن کارکرد متفاوتی رو نشان دادند.
- نقش آنزیم دایسر (Dicer ) در سیستم RNA مداخله گر (RNAi)
اعضای خانواده RNase III دارای تعدادی از نوکلئازها هستند که برای RNAهای دو رشته ای به صورت اختصاصی عمل می کنند نوکلئازها RNAهای دو رشته ای را برش می دهند و انتهای 5 فسفات و ۳ هیدروکسیل را از دو انتها به وجود می آورند که انتهای ۳ دارای ۲ یا ۳ نوکلوتید آویزان می باشد.
در سال 2011 آنزیم شبه RNaselII را از مگس سرکه جداسازی کردند که توانایی تولید قطعات ۲۲ نوکلوتید شبیه به محصولات تولید شده در RNAi را دارا بود این دانشمندان نشان دادند که این آنزیم برای شروع RNAi ضروری است.
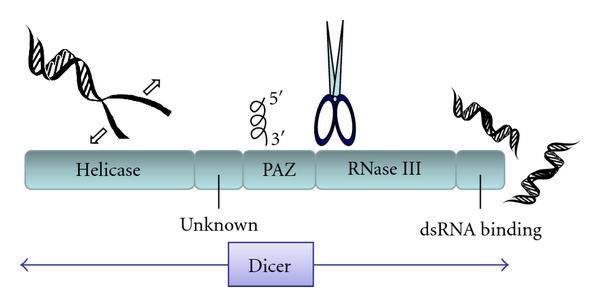
به خاطر توانایی برش dsRNA به قطعات با اندازه کوچک و یکسان این آنزیم Dicer نامیده شد. که به صورت DCR مخفف می شود و محصول آن را small interfering RNA (siRNA)می نامند. این نوکلئاز در کرم ها، مگس ها، قارچ ها و گیاهان و پستان داران حفظ شده است. Dicer دارای چهار ناحیه می باشد، ناحيه هلیکازی با انتهای آمینی، ناحیه دو گانه RNaseIII، ناحيه متصل شونده به dsRNA و ناحیه PAZ می باشد
عمل برش دایسر به وسیله ناحیه دوگانه RNaseIII انجام می شود. معمولا دو واحد دایسر با ایجادچهار مرکز کاتالیتیک بر روی dsRNA عمل می کنند.
- نقش آنزیم RNA – Induced silencing complex ) RISC) در سیستم RNA مداخله گر (RNAi)
کمپلکس القا کننده خاموشی یک ترکیب پیچیده است که با اتصال به siRNA به واسطه رشته آنتی سنس آن به سمت توالی مشابه بر روی mRNA هدایت می شود و با بخش نوکلئازی خودش منجر به تخریب mRNA هدف می گردد. این ترکیب ریبونوکلئوپروتئینی KDa500 وزن دارد. هنوز اجزا دقیق RISC به طور کامل شناسایی نشده اند اما برخی از اجزای آن شامل موارد ذیل است:
- پروتئین های متصل شونده به (RNA ( RNA binding proteins .
- هلیکاز که سبب باز شدن دو رشته siRNA از هم می شود.
- (RdRp (RNA dependent RNA polymerase که به کمک آن RNA تک رشته ای، دو رشته ای می شود. RdRP نقش بسیار مهمی در تکثیر سیگنال siRNA بازی می کند و اجازه گسترش آن را در سراسر بدن موجود می دهد. هم چنین RdRP ممكن است مسئول ادامه دادن PTGS و نگه داری سطح آن در غیاب dsRNA باشد.
پروتئین های درون غشایی (Transmembrane proteins) : انتشار سیستمیک خاموشی ژن از یک سلول به سلول دیگر به خوبی در موجودات مختلف روشن شده است در این زمینه یک سری از پروتئین ها نقش دارند که احتمالا بخشی از RISC هستند و به عنوان کانال یا گیرنده جهت انتشار سیستمیک سیگنال های خاموشی که همان siRNA ها هستند عمل می کنند.
- پروتئین های نوکلئازی در هنگام اتصال به mRNA باعث تجزیه آن می شوند.
یکی از روش های تنظیم بیان ژن ها، تنظیم بیان در سطح رونویسی می باشد و متیلاسیون DNA روش اصلی خاموشی ژن و تنظیم بیان آن در سطح رونویسی محسوب می شود. مطالعات جدید نشان داده است که siRNA بر روی میزان متیلاسیون DNA تاثیر گذار هست.
برای اولین بار نقش RNA در متیلاسیون توالی های DNA همولوگ در گیاهان آلوده به ویروس کشف شد، اما پس از آن، این مکانیسم در سیستم های گیاهی غیر بیماری زا نیز مشخص شد. این مکانیسم هم در فرآیندهای خاموشی در سطح رونویسی و هم در فرآیندهای خاموشی پس از رونویسی عمل می کند. به همین دلیل است که گفته می شود امروزه، تفکیک این دو فرآیند از هم در سلول بسیار مشکل است. معمولا این مکانیسم با حضور یک RNA دو رشته ای (dsRNA) شروع می شود که این RNA دو رشته ای می تواند از یک siRNA به دست آید. به عبارتی در روش خاموشی ژن در سطح رونویسی و در حضور یک dsRNA، تمامی همولوگهای RNA که از جنس DNA هستند، در مناطق حساس به سیتوزین متیله می شوند. بسته به اطلاعات توالی dsRNA متیلاسیون DNA وابسته به RNA می تواند در منطقه چارچوب قرائت و یا در منطقه پیشبر واقع شود. اگر متیلاسیون فقط در منطقه ORF یا در حقیقت همان توالی کد کننده واقع شود، خاموشی در سطح رونویسی نخواهد بود. در واقع این نوع از متیلاسیون به خاموشی پس از رونویسی نسبت داده می شود. در حالی که وقوع این پدیده در ناحیه پیشبر سبب القای خاموشی در سطح رونویسی خواهد شد که پایدار بوده و وراثت پذیر (در مقایسه با مکانیسم متیلاسیون در روش خاموشی پس از رونویسی) است.
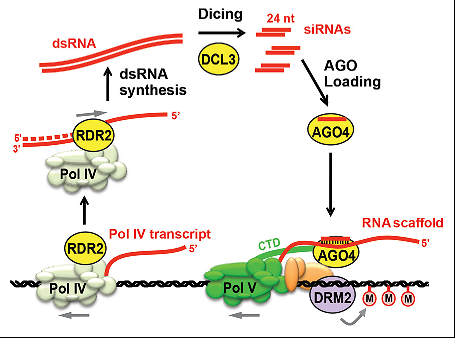
مقدار متیلاسیون DNA بطور مستقیمی با مقدار siRNA موجود در سلول مرتبط است. به عبارت دیگر دسترسی به siRNA، تعیین کننده سطح متیلاسیون DNA وابسته به RNA است. در مکانیسم متیلاسیون DNA وابسته به RNA که از این پس به اختصار با RdDM نشان داده می شود، کرومودمین های حاوی DNA متیلازها به تنهایی یا در ترکیب با پروتئین های دیگر مثل پروتئین های حاوی piwi برای تشکیل کمپلکس هایی با siRNA ها عمل می کنند که ماحصل آن، متیله شدن DNA و در نتیجه ممانعت از رونویسی آن است که منجر به خاموشی ژن خواهد شد. RdDM در سراسر نمو گیاه مشاهده می شود که بر دسترسی مداوم متیل ترانسفرازها به DNA گیاهی دلالت دارد.





