پروتئین
پرُوتِئین (به انگلیسی: protein) از جمله مهمترین اجزای بدن است که نقشهای بسیار حیاتی و مهمی در بدن را دارد. این مواد از توالی زنجیرههای آمینواسیدی تشکیل شدهاند که براساس نوع پروتئین، تعداد این آمینواسیدها میتواند تا چند هزار نیز برسد. پروتئینها طبق نوع و محل حضورشان عملکرد متفاوتی دارند، از جمله این وظایف میتوان به فعالیت آنزیمی به منظور کاتالیز فرایند، شناسایی میکروبها و سلولهای سرطانی، انتقال موادی مانند گازهای تنفسی و سیگنالدهی اشاره کرد.

پروتئینها مانند زنجیری از یک کلاف سهبعدی بسپارهایی هستند که از ترکیب اسیدهای آمینه حاصل میشوند. اسیدهای آمینه مثل یک زنجیر خطی توسط پیوند پپتیدی میان گروههای کربوکسیل و آمین مجاور به یکدیگر متصل میشوند تا یک پلی پپتید را به وجود بیاورند.
ترتیب اسیدهای آمینه در یک پروتئین توسط ژن مشخص میشود. اگرچه کد ژنتیک ۲۰ تا اسید آمینه استاندارد را معرفی میکند، اما در بعضی از اندامگانها (ارگانیسمها) کد ژنتیک شامل سلنوسیستئین و در بعضی از آرکیباکتریها پیرولیزین میباشد. گاهی در پروتئینها دگرگونی به وجود میآید: یا قبل از آنکه پروتئین بتواند به وظایفش در یاخته عمل کند یا به عنوان قسمتی از مکانیسم بازرسی. پروتئینها معمولاًبه یکدیگر میپیوندند تا یک وظیفهای را با یکدیگر انجام دهند که این خود باعث استوار شدن پروتئین میشود. چون ترتیبهای نامحدودی در توالی و طول زنجیره اسید آمینهها در تولید پروتئینها وجود دارد، از این رو انواع بیشماری از پروتئینها نیز میتوانند وجود داشته باشند. پروتئینهای درونیاختهای در بخشی از سلول به نام ریبوزوم توسط آرانای (RNA) ساخته میشوند.
پروتئین چیست؟
پروتئینها ماکرومولکولهای زیستی هستند که عملکردهای اساسی مانند نقش هورمونی، آنزیمی و ساختاری را در بدن بر عهده دارند. اکثر پروتئین ها از پلیمرهای خطی ساخته شده از مجموعهای تا 20 اسید آمینه مختلف ساخته شدهاند. همه اسیدهای آمینه دخیل در ساختمان پروتئینها، دارای ویژگیهای ساختاری مشترکی از جمله یک کربن آلفا، یک گروه آمین، یک گروه کربوکسیل و یک زنجیره جانبی با ساختار متغیر هستند.
اسیدآمینه پرولین به دلیل ساختار حلقهای غیرمعمول خود با دیگر اسیدهای آمینه متفاوت است. زنجیرههای جانبی آمینو اسیدهای استاندارد که در لیست اسیدهای آمینه استاندارد ذکر شدهاند، دارای تنوع زیادی در ساختارها و خواص شیمیایی هستند. این اثر ترکیبی تمام زنجیرههای جانبی آمینو اسید در یک پروتئین است که در نهایت ساختار سه بعدی و واکنش شیمیایی آن را تعیین میکند.
اسیدهای آمینه موجود در یک زنجیره پلیپپتیدی با پیوندهای پپتیدی مرتبط میشوند. به محض اتصال در زنجیره پروتئین، یک آمینواسید جداگانه باقیمانده نامیده میشود و مجموعه پیوند یافته اتمهای کربن، نیتروژن و اکسیژن به عنوان زنجیره اصلی یا ستون فقرات پروتئین شناخته میشوند.
کشف پروتئین ها
پروتئینها در قرن هجدهم توسط «آنتوان فورکروی» (Antoine Fourcroy) و گروهی دیگر از دانشمندان به عنوان گروهی از مولکولهای زیستی که توانایی متراکم شدن یا لخته شدن تحت تیمارهای حرارتی یا اسیدی را داشتند، از سایر بیومولکولها متمایز شدند. پروتئینهای که در آن زمان مورد توجه قرار گرفتند شامل آلبومین از سفیده تخم مرغ و سرم خون، فیبرین و گلوتن گندم بودند.
دشواری در استخراج و تخلیص پروتئینها در مقادیر بالا، مطالعه آنها را برای بیوشیمیستها بسیار دشوار کرده بود. از این رو، مطالعات اولیه بر روی پروتئین هایی متمرکز بود که در مقادیر بالا قابل تخلیص بودند مانند پروتئینهای خون، سفیده تخم مرغ، سموم مختلف و آنزیمهای گوارشی به دست آمده از دامها.
در دهه 1950، شرکت «Armor Hot Dog» با استخراج یک کیلوگرم ریبونوکلئاز A از لوزالمعده گاو و در دسترس قرار دادن آن، کمک کرد تا ریبونوکلئاز A برای دهههای بعدی به یک هدف اصلی برای مطالعه بیوشیمیایی تبدیل شود.
انسولین اولین پروتئینی بود که توالی آن توسط فردریک سنگر در سال 1949 مشخص شد. سنگر توالی اسید آمینه انسولین را به درستی تعیین کرد و اثبات کرد که پروتئینها از پلیمرهای خطی اسیدهای آمینه تشکیل شدهاند. سنگر برای این موفقیت در سال 1958 جایزه نوبل را از آن خود کرد و این روش به نام او شناخته شد.
هموگلوبین و میوگلوبین اولین ساختارهای پروتئینی بودند که در سال 1958 به ترتیب توسط ماكس پروز و سر جان كودری كندرو شناخته شدند. از سال 2017، بانک اطلاعات پروتئین بیش از ۱۲۶ هزار ساختار پروتئینی را با وضوح اتمی دارد. در سالهای اخیر، استفاده از میکروسکوپ الکترونی کرایو (cryo-EM) برای ماکرومولکولها و پیشبینی ساختار پروتئینها برای دامینهای کوچک پروتئینی، دو روش تعیین توالی پروتئینها با دقت اتمی هستند. برای مطالعه بیشتر در مورد پروتئینها که از مهمترین ماکرومولکولها هستند، میتوانید فیلم آموزشی که در ادامه لینک آن آمده است را ببینید.
نقش پروتئین در بدن چیست؟
پروتئینها مجموعهای از عملکردهای حیاتی را در ارگانیسمها انجام میدهند و منجر به بروز فنوتیپ خاص آنها میشوند. از جمله فعالیتهای مهم پروتئینها میتوان موارد زیر را نام برد:
- واکنشهای متابولیکی کاتالیزوری
- همانندسازی DNA
- پاسخ به محرکها
- نقش ساختاری در غشای سلولی
- انتقال مولکولها از یک مکان به مکان دیگر
- تنظیم فعالیتهای سلولی
پروتئینها با مولکولهای فراوانی مانند پروتئینهای دیگر، لیپیدها، کربوهیدراتها و DNA میانکنش میدهند.
مقدار پروتئین ها در سلول
تخمین زده میشود که مقدار پروتئین در یک باکتری با اندازه متوسط، حدود دو میلیون عدد است. در باکتریهای کوچکتر مانند مایکوپلاسما و اسپیروشیتها، بین ۵۰ هزار تا یک میلیون مولکول پروتئینی وجود دارد. اما در سلولهای یوکاریوت به دلیل بزرگتر و پیچیدهتر بودن، مقدار پروتئینها نیز بیشتر است. به عنوان مثال، سلولهای مخمر حاوی حدود 50 میلیون پروتئین و سلول انسانی به میزان 1 تا 3 میلیارد پروتئین دارند.
تعداد نسخههای جداگانه پروتئین از چند مولکول در هر سلول تا 20 میلیون است. همه پروتئینهایی که کد ژنتیکی آنها در سلول وجود دارند، در یک سلول بیان نمیشوند بنابراین تعداد و نوع پروتئینهای هر سلول به نوع، عملکرد و محرکهای خارجی آن بستگی دارد.
از حدود ۲۰ هزار پروتئین رمزگذاری شده توسط ژنوم انسان، فقط 6000 پروتئین در سلولهای لنفوبلاستوئید شناسایی شدهاند. علاوه بر این، تعداد پروتئینهایی که ژنوم رمزگذاری میکند با پیچیدگی ارگانیسم ارتباط دارد. یوکاریوتها 15000، باکتریها 3200، آرکئیها 2400 و ویروسها 42 پروتئین دارند که به طور متوسط در ژنوم آنها رمزگذاری شدهاند.
اسیدهای آمینه و ساختار آنها
پروتئین ها درشت مولکول هایی هستند که از مونومرهایی به نام اسیدهای آمینه تشکیل شده اند. آمینو اسیدها واحد سازنده همه پروتئین ها هستند. اسید آمینه یک ترکیب آلی ساده است که از یک گروه بازی (-NH2)، یک گروه اسیدی (-COOH) و یک گروه R آلی تشکیل شده است که برای هر اسید آمینه منحصر به فرد است. واژه اسید آمینه کوتاه کلمه آلفا آمینو کربوکسیلیک اسید است. هر مولکول دارای یک اتم کربن مرکزی به نام α-کربن است که هر دو گروه به آن متصل هستند. دو پیوند باقی مانده برای کربن مرکزی توسط اتم هیدروژن و یک گروه R آلی پر می شوند. گروه R آلی می تواند به سادگی یک اتم هیدروژن (H) یا یک گروه متیل (-CH3) یا یک گروه پیچیده تر باشد. بنابراین، کربن α در همه اسیدهای آمینه نامتقارن است به جز در گلیسین که در آن کربن α با یک اتم هیدروژن به عنوان یک گروه R متقارن است. به دلیل این عدم تقارن، آمینو اسیدها (به جز گلیسین) به دو شکل فعال نوری وجود دارند: آنهایی که دارای گروه NH2 در سمت راست هستند به عنوان فرم D و آنهایی که دارای گروه NH2 در سمت چپ به عنوان فرم L هستند. خاصیت وجود به دو شکل نوری متفاوت به عنوان کایرالیته نامیده می شود. آمینواسیدها ترکیباتی آمفوتریک با هر دو گروه اسیدی و قلیایی هستند. اینها نیز همیشه به صورت یون به جز در نقطه ایزوالکتریک وجود دارند.
- فرمول کلی اسید آمینه به صورت زیر است:
R-CH(NH2)-COOH

پروتئین چیست؟
پروتئین ها ماکرومولکول های بسیار پیچیده ای هستند که از یک یا چند زنجیره بلند آمینواسید تشکیل شده اند که توسط پیوندهای پپتیدی به هم متصل شده اند. پروتئین یک مولکول درشت مغذی است که در همه موجودات زنده وجود دارد و مستقیماً در مسیرهای متابولیک مختلف دخالت دارد. پروتئین ها برای گونه های خاص هستند و برای هر موجودی منحصر به فرد می باشند. همچنین پروتئین ها برای هر اندام اختصاصی هستند، چرا که پروتئینهای مغز با پروتئینهای ماهیچهها متفاوت است. پروتئین ها از 20 اسید آمینه مختلف تشکیل شده اند و خاصیت یک مولکول پروتئین تابعی از اسیدهای آمینه موجود است. گیاهان قادر به سنتز تمام اسیدهای آمینه لازم برای ساخت پروتئین هستند، در حالی که حیوانات نمی توانند همه آنها را تولید کنند.
اسیدهای آمینه در پروتئین ها توسط پیوندهای پپتیدی که بین گروه NH2 یک اسید آمینه به گروه COOH یک اسید آمینه دیگر تشکیل می شود، به یکدیگر متصل می شوند. پروتئین ها نیز پلی پپتید نامیده می شوند، زیرا آنها زنجیره های بلندی از اسیدهای آمینه هستند که توسط پیوندهای پپتیدی به هم متصل می شوند.
سنتز پپتیدها
پپتید یک زنجیره کوتاه است که از اسید آمینه تشکیل شده است که همراه با سایر پپتیدها یک پروتئین را تشکیل می دهد. زنجیره های پپتیدی زمانی تشکیل می شوند که دو یا چند اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شوند. یک زنجیره پپتیدی می تواند به اندازه دو اسید آمینه داشته باشد. پپتیدهای بلندتر به نام پلی پپتید دارای پنجاه تا صد اسید آمینه هستند. پپتیدها بر اساس تعداد اسیدهای آمینه موجود در پپتید به گروههای مختلفی دستهبندی میشوند. پپتیدهای دارای دو اسید آمینه دی پپتید نامیده می شوند در حالی که پپتیدهایی با بیش از ده اسید آمینه پلی پپتید نامیده می شوند. پیوند پپتیدی تشکیل شده در پروتئین ها نوع خاصی از پیوند آمیدی است که بین دو مولکول وجود دارد که در آن یک گروه α-کربوکسیل از یک مولکول با گروه α-آمینه یک مولکول دیگر ترکیب می شود. بنابراین زنجیره اسیدهای آمینه حاصل پپتید نامیده می شود.
تشکیل پیوند پپتیدی
یک پیوند پپتیدی بین دو مولکول اسید آمینه تشکیل می شود که در آن گروه α-کربوکسیل یک مولکول آمینو اسید با گروه α-آمینه یک مولکول مجاور واکنش می دهد و در نتیجه نوع خاصی از پیوند آمیدی ایجاد می شود.
تراکم
واکنش درگیر در تشکیل پیوند پپتیدی نمونه ای از واکنش تراکم است که منجر به کم آبی (حذف آب) می شود. تشکیل پیوند پپتیدی زمانی آغاز می شود که گروه کربوکسیل یک اسید آمینه به سمت گروه آمین اسید آمینه دیگر حرکت می کند. در طول فرآیند، یک گروه هیدروکسیل (OH) از گروه کربوکسیل (COOH) اولین اسید آمینه از بین می رود در حالی که، یک هیدروژن از گروه آمین (NH2) اسید آمینه دیگر از بین می رود. بنابراین، یک مولکول آب (H2O) همراه با تشکیل یک پیوند آمیدی (C-N) بین دو اسید آمینه آزاد می شود. تشکیل یک پیوند پپتیدی منفرد بین دو اسید آمینه باعث ایجاد یک مولکول دی پپتیدی می شود.
هیدرولیز
هیدرولیز پپتید یک فرآیند ضروری در برخی از واکنش های مصنوعی است که در آن اسیدهای آمینه در یک پپتید شکافته شده و به پپتید دیگر منتقل می شوند و در نتیجه یک زنجیره پپتیدی جداگانه سنتز می شود. هیدرولیز پیوند پپتیدی نیز یکی از مکانیسم های تخریب پیوند پپتیدی است. این شامل تقسیم پلی پپتیدها به پپتیدهای کوچکتر یا تجزیه پپتیدهای کوچکتر به مولکولهای اسید آمینه منفرد است. هیدرولیز پیوند پپتیدی با حضور اسید کاتالیز می شود و شامل افزودن یک مولکول آب است. در طول هیدرولیز، یک مولکول آب بین پیوند CO-NH در توالی پپتیدی وارد می شود. در نتیجه، دو اسید آمینه با گروه NH2 انتهایی در یک و گروه COOH در دیگری از هم جدا می شوند.
پلی پپتید چیست؟
- پلی پپتیدها زنجیره های بلندی از اسیدهای آمینه هستند که در آن بیش از ده اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شده اند.
- یک یا چند پلی پپتید متصل به هم پروتئین را تشکیل می دهند.
- یک سر یک پلی پپتید دارای یک گروه آمینه آزاد به نام ترمینال آمین یا ترمینال N است، در حالی که انتهای دیگر دارای یک گروه کربوکسیل آزاد به نام کربوکسیل ترمینال یا ترمینال C است.
- توالی اسیدهای آمینه در یک پلی پپتید توسط کدون های موجود در RNA پیام رسان که پلی پپتید از آن ترجمه می شود تعیین می شود.
- توالی کدون ها در mRNA به نوبه خود به توالی های نوکلئوتیدی در مولکول DNA وابسته است.
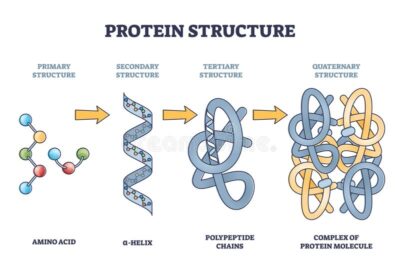
ساختار پروتئین
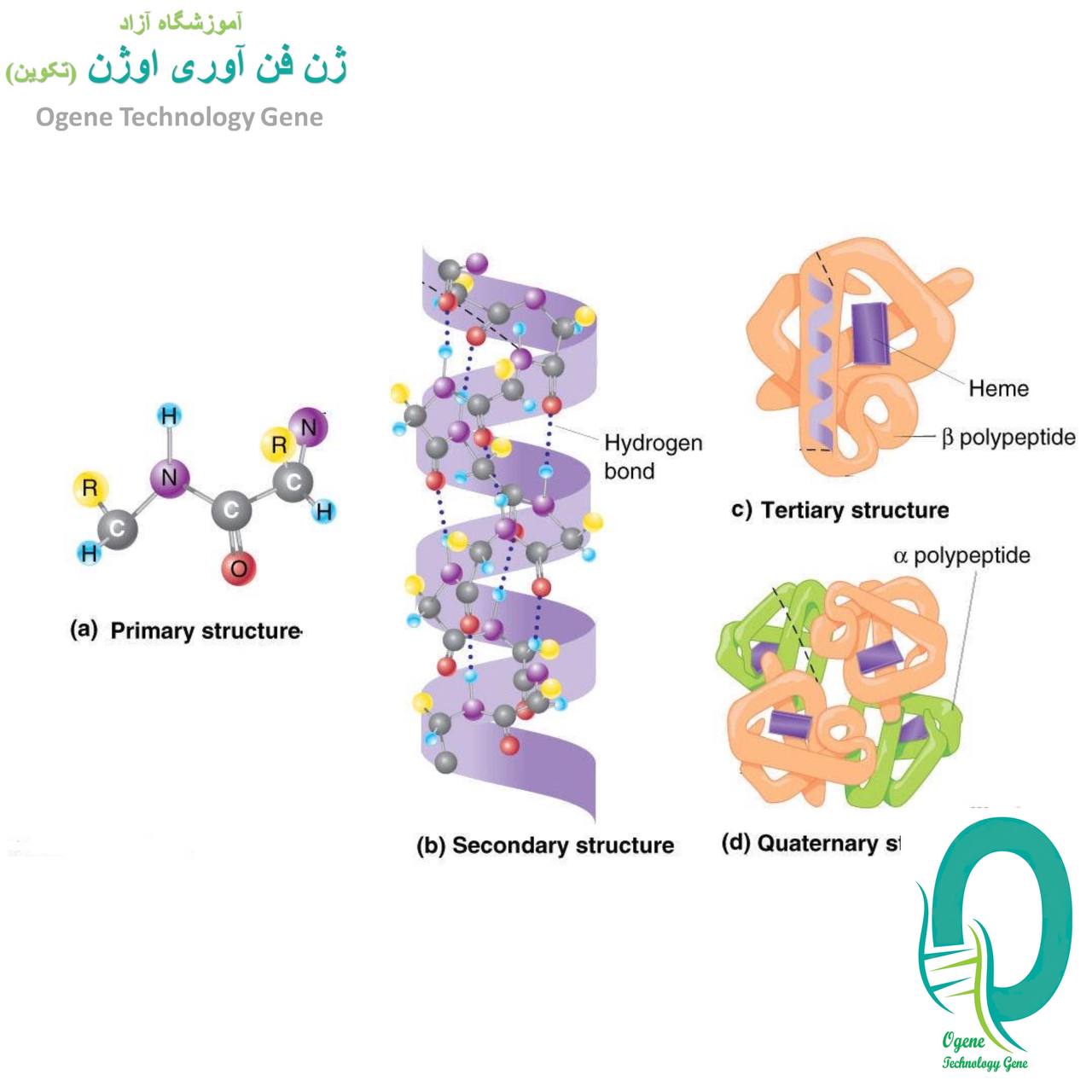
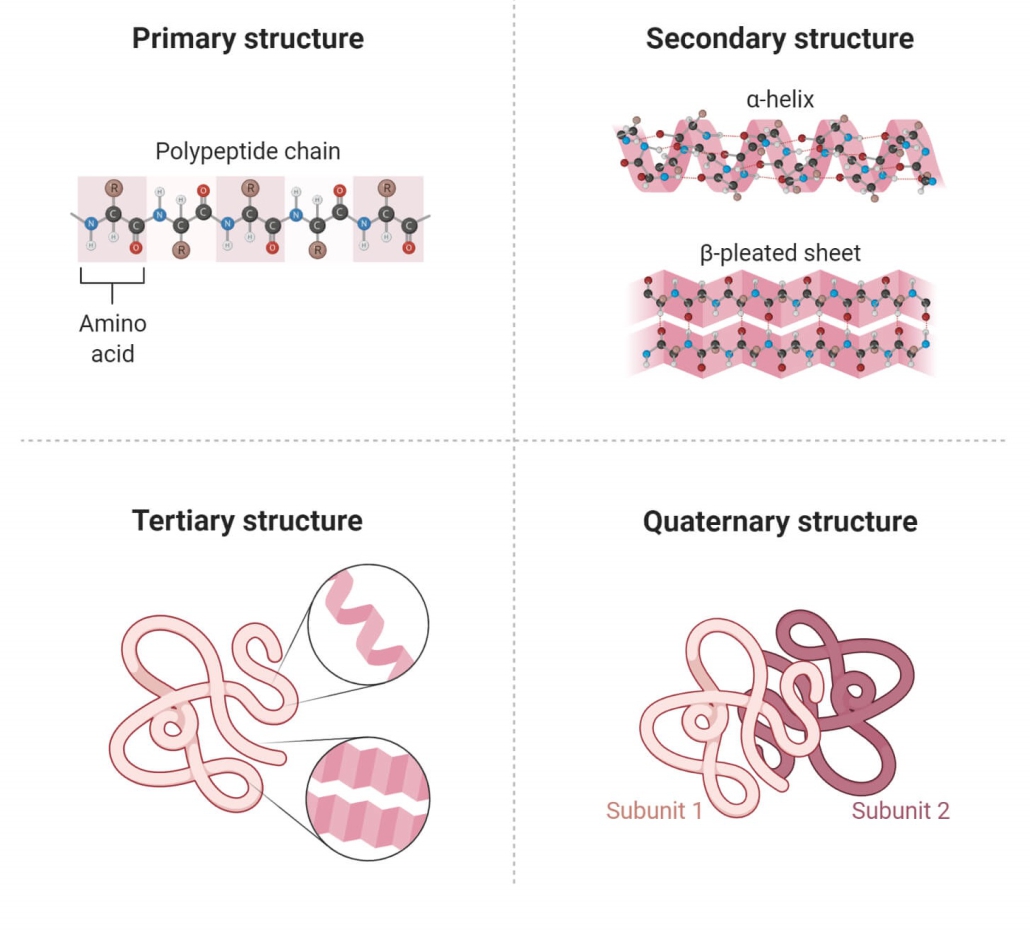
از آنجایی که پروتئین یک ماکرومولکول پیچیده است، ساختار آن با استفاده از چهار سطح ساختاری اساسی سازمان توصیف شده است. این سطوح ساختاری اغلب به عنوان اولیه، ثانویه، سوم و چهارم نامیده می شوند.
سه مورد از این سطوح ساختاری (اولیه، ثانویه و سوم) میتوانند در مولکولهای متشکل از یک زنجیره پلی پپتیدی منفرد وجود داشته باشند. در مقابل، ساختار چهارم شامل برهمکنش پلی پپتیدها در یک مولکول پروتئین چند زنجیره ای است.
ساختار اولیه
ساختار اولیه یک پروتئین به عنوان دنباله ای از اسیدهای آمینه به هم متصل شده و یک زنجیره پلی پپتیدی تشکیل می شود. هر اسید آمینه از طریق پیوندهای پپتیدی ایجاد شده در طی فرآیند بیوسنتز پروتئین به اسید آمینه بعدی متصل می شود. دو انتهای هر زنجیره پلی پپتیدی به عنوان پایانه آمین (N-terminus) و انتهای کربوکسیل (C-terminus) شناخته می شوند. بیست اسید آمینه مختلف را می توان چندین بار در یک پلی پپتید برای ایجاد یک توالی ساختار پروتئین اولیه خاص استفاده کرد.
ساختار اولیه پروتئین ها ترتیب دقیق اسیدهای آمینه است که زنجیره آنها را تشکیل می دهند. توالی دقیق پروتئین ها بسیار مهم است زیرا چین خوردگی نهایی و در نتیجه عملکرد پروتئین را تعیین می کند. تعداد زنجیره های پلی پپتیدی با هم پروتئین ها را تشکیل می دهند.
ساختار ثانویه
ساختار اولیه خطی و بازشده زنجیره پلی پپتیدی اغلب یک شکل مارپیچ برای تولید ساختار ثانویه به خود می گیرد. ساختار ثانویه پروتئین ها به رابطه فضایی یا فضایی اسیدهای آمینه نزدیک به یکدیگر در توالی اسید آمینه اشاره دارد. چین خوردگی زنجیره عمدتاً به دلیل وجود پیوندهای هیدروژنی است که می تواند درون مولکولی یا بین مولکولی باشد.
تاخوردگی و پیوند هیدروژنی بین اسیدهای آمینه همسایه منجر به تشکیل ساختاری صلب و لولهای به نام مارپیچ میشود. ساختارهای ثانویه در پروتئین ها بر اساس ماهیت پیوند هیدروژنی دو نوع هستند. آلفا هلیکس (α-helix) و صفحات بتا (β-sheet).
آ. ساختار آلفا مارپیچ
ساختار آلفا مارپیچ زمانی تشکیل می شود که گروه CO هر اسید آمینه با پیوند هیدروژنی به گروه NH اسید آمینه که چهار باقیمانده جلوتر در توالی خطی وجود دارد، متصل شود. ساختار α-مارپیچ به پیوند هیدروژنی درون مولکولی بین گروه های NH و CO پیوندهای پپتیدی بستگی دارد.
ب. صفحات بتا
ساختار صفحات بتا از هم ترازی موازی تعدادی زنجیره پلی پپتیدی، با پیوندهای هیدروژنی بین گروه های C=O و N-H زنجیره های مجاور تشکیل می شود. گروه های R آمینو اسیدهای تشکیل دهنده در یک زنجیره پلی پپتیدی به طور متناوب در بالا و زیر صفحه ورق قرار می گیرند. تشکیل صفحات بتا به پیوند هیدروژنی بین مولکولی بستگی دارد، اگرچه پیوندهای هیدروژنی درون مولکولی نیز وجود دارد.
ج. ساختار سوم
ساختار سوم مولکول پروتئین یک ساختار سه بعدی از پروتئین است که از تا شدن ساختار ثانویه در الگوهای خاصی تشکیل شده است. ساختار سوم عموماً توسط برهمکنشهای هیدروژن آبدوست و پیوند یونی خارجی قطبی و برهمکنشهای آبگریز داخلی بین زنجیرههای جانبی اسید آمینه غیرقطبی تثبیت میشود. بر اساس ساختار سوم، پروتئین ها اغلب به انواع کروی یا فیبری تقسیم می شوند.
a. پروتئین های فیبری
پروتئین های فیبری ساختارهای طناب مانند درازی دارند که قوی و آبگریز هستند و معمولاً عمدتاً از یک نوع ساختار ثانویه تشکیل شده اند. ساختارهایی که حمایت، شکل و محافظت خارجی را برای مهره داران فراهم می کنند از پروتئین های فیبری مانند α-کراتین ساخته شده اند.
b. پروتئین های کروی
پروتئین های کروی اغلب حاوی چندین نوع ساختار ثانویه هستند و بیشتر کروی و آبدوست هستند. بنابراین، بیشتر آنزیم ها و پروتئین های تنظیم کننده مانند ایمونوگلوبولین ها پروتئین های کروی هستند.
د. ساختار کواترنری
ساختار کواترنر یک ویژگی پروتئینی مهم است که ارتباط نزدیکی با عملکرد آن دارد. پروتئین هایی که ساختار چهارتایی دارند، پروتئین های الیگومری نامیده می شوند. پروتئین های الیگومر در فرآیندهای بیولوژیکی مختلفی مانند متابولیسم، انتقال سیگنال و همانندسازی کروموزوم نقش دارند.
پیوند پروتئین
علاوه بر پیوندهای پپتیدی اولیه، چندین پیوند ثانویه دیگر مسئول تشکیل ساختار خالص پروتئین ها هستند.
برخی از پیوندهای ثانویه رایج موجود در پروتئین ها عبارتند از:
1. پیوند هیدروژنی
پیوند هیدروژنی در پروتئین ها به دلیل تمایل یک اتم هیدروژن که به طور کووالانسی به یک اتم الکترونگاتیو پیوند دارد برای به اشتراک گذاشتن الکترون ها با اتم های مجاور مانند O یا N تشکیل می شود. در یک پیوند پپتیدی، پیوند هیدروژنی را می توان به صورت زیر مشاهده کرد:
-C=O∙∙∙∙∙∙∙∙∙∙∙∙HN-
خط نقطه چین بین اتم های اکسیژن و هیدروژن در پیوند پپتیدی نشان دهنده یک پیوند هیدروژنی است. پیوند هیدروژنی در پروتئین مهم است زیرا ساختار ثانویه پروتئین ها را تثبیت می کند.
2. پیوندهای یونی
پیوندهای یونی در پروتئین ها بین گروه های اسیدی و بازی اسیدهای آمینه تشکیل دهنده مشاهده می شود. فعل و انفعالات الکترواستاتیکی نیز بین گروه های دارای بار متفاوت موجود در زنجیره های جانبی اسیدهای آمینه وجود دارد. گروه های یونیزه به جای تثبیت ساختار پروتئین در تثبیت فعل و انفعالات بین پروتئین و سایر مولکول ها نقش دارند. این پیوندهای یونی، اگرچه ضعیف تر از پیوندهای هیدروژنی هستند، اما مسئول حفظ ساختار سه بعدی یا ساختار سوم پروتئین های کروی هستند.
3. پیوندهای دی سولفیدی
پیوند دی سولفیدی دومین نوع پیوند کووالانسی است که بین بقایای اسید آمینه در پروتئین ها و پلی پپتیدها یافت می شود. این پیوند با اکسیداسیون گروه های تیول یا سولفیدریل (-SH) از دو باقی مانده سیستئین برای تولید سیستئین ایجاد می شود. حتی اگر پل های دی سولفیدی در مقایسه با استحکام پیوندهای غیرکووالانسی بسیار قوی باشند، آنها برد کوتاهی دارند و تنها زمانی که پیوند کاملاً تشکیل شد می توانند ساختار سوم را تثبیت کنند.
فعل و انفعالات آبگریز و آب دوست
فعل و انفعالات آبگریز بین زنجیره های جانبی یا گروه های R اساساً آبگریز رخ می دهد. گروه های آبگریز در بین خود متحد می شوند و باعث می شوند که آب از بین برود و پیوندهایی بین بخش های مختلف یک زنجیره یا بین زنجیره های مختلف ایجاد کند. فعل و انفعالات آبگریز همچنین ممکن است به پیوندهای دیگری مانند پیوندهای هیدروژنی یا پیوندهای یونی بین گروه های دیگر منجر شود. پیوندهای آبگریز همچنین به سایر فعل و انفعالات پروتئینی کمک می کنند، به عنوان مثال، تشکیل کمپلکس های آنزیم- سوبسترا و برهمکنش های آنتی بادی-آنتی ژن. فعل و انفعالات آبدوست منجر به پیوند هیدروژنی بین اتم های الکترونگاتیو و اتم های هیدروژن می شود.
پروتئین های فیبری
- کلاژن
- کراتین
- الاستین
1. کلاژن
کلاژن فراوان ترین پروتئین پستانداران است که حدود 25 تا 33 درصد از کل پروتئین های بدن را تشکیل می دهد. این عنصر ساختاری اصلی بدن انسان است که در بافت های همبند مانند تاندون ها، غضروف ها، ماتریکس آلی استخوان ها و قرنیه چشم یافت می شود. از نظر ساختاری، مارپیچ کلاژن یک ساختار ثانویه منحصر به فرد است که کاملاً از مارپیچ α متمایز است. چپ دست است و در هر نوبت سه باقی مانده اسید آمینه وجود دارد. کلاژن نیز یک سیم پیچ پیچ خورده است، اما با ساختارهای سوم و چهارم مشخص که در آن سه پلی پپتید مجزا به نام زنجیره α در اطراف یکدیگر پیچیده شده اند. به طور معمول آنها حاوی حدود 35٪ گلیسین، 11٪ آلانین، و 21٪ پرولین و 4-هیدروکسی پرولین هستند.
2. کراتین
کراتین یا α-کراتین یک پروتئین فیبری است که تقریباً کل وزن خشک مو، پشم، ناخن، پنجه، شاخ، سم و بیشتر لایه بیرونی پوست پستانداران را تشکیل میدهد. α-کراتین ها بخشی از خانواده وسیع تری از پروتئین ها به نام پروتئین های رشته میانی (IF) هستند. مارپیچ α-کراتین یک مارپیچ α راست دست است، ساختار ثانویه ای که در بسیاری از پروتئین های دیگر یافت می شود. دو رشته α-کراتین که به صورت موازی قرار گرفته اند، در اطراف یکدیگر پیچیده شده اند تا یک سیم پیچ فوق العاده پیچ خورده را تشکیل دهند که استحکام ساختار کلی را تقویت می کند. یک پلی پپتید مجزا در سیم پیچ آلفا-کراتین دارای ساختار سوم نسبتاً ساده است که توسط یک ساختار ثانویه α-مارپیچ با محور مارپیچ آن که در یک ابرمارپیچ چپ گرد پیچ خورده است، غالب است. درهم تنیدگی دو پلی پپتید α-مارپیچ در کراتین به عنوان نمونه ای از ساختار چهارتایی عمل می کند.
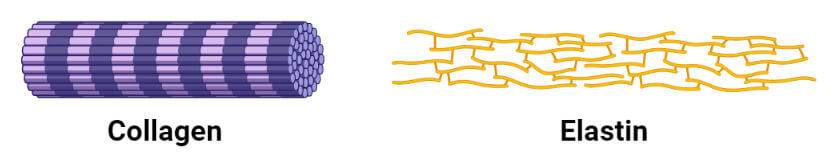
3. الاستین
الاستین یک پروتئین اصلی است که در اندام های مختلفی یافت می شود که به خاصیت ارتجاعی نیاز دارند مانند: ریه ها، مثانه و غضروف های الاستیک
زنجیره پلی پپتیدی از پروتئین تروپوالاستین، حاوی گلیسین و والین و آلانین و پرولین اصلاح شده تشکیل شده است. به دلیل عملکرد ساختاری و نامحلول بودن در آب به عنوان پروتئین فیبری طبقه بندی می شود. الاستین فاقد ساختار ثانویه منظم است و دارای پیوندهای متقابل توالی های مختلف پروتئین است. الاستین همچنین غنی از گلیسین و پرولین است، اما مولکول گلیسین مانند هر باقی مانده سوم در کلاژن ندارد.
پروتئین های گلوبولار
- هموگلوبین
- انسولین
- پپسین
1. هموگلوبین
- هموگلوبین ناقل اکسیژن در گلبول های قرمز است و حدود 90 درصد پروتئین گلبول های قرمز را تشکیل می دهد.
- این یک پروتئین تترامری با چهار زنجیره پلی پپتیدی است که توسط فعل و انفعالات غیرکووالانسی به هم متصل می شوند.
- دو تا از چهار زنجیره پلی پپتیدی زنجیره α هستند و دو زنجیره باقی مانده زنجیره β هستند.
- زنجیره های α و β هموگلوبین حاوی چندین بخش از مارپیچ α هستند که به صورت یک جفت توسط پیوندهای یونی و هیدروژنی کنار هم قرار گرفته اند.
- به طور مشابه، چهار زنجیره پلی پپتیدی تقریباً به صورت چهار وجهی با هم قرار می گیرند تا ساختار چهارتایی مشخصه را ایجاد کنند.
2. انسولین
- انسولین یک هورمون پپتیدی است که توسط سلول های بتا پانکراس تولید می شود و متابولیسم کربوهیدرات ها، چربی ها و پروتئین ها را تنظیم می کند.
- انسولین تولید شده در بدن به شکل هگزامر ذخیره می شود، اما شکل فعال آن یک مونومر است.
- هگزامر به عنوان راهی برای پایدار نگه داشتن پروتئین و محافظت از آن عمل می کند.
- یک تک مونومر پروتئینی انسولین از 51 اسید آمینه تشکیل شده است که توسط دو زنجیره پپتیدی که توسط پیوندهای دی سولفیدی به هم مرتبط شده اند تشکیل شده است.
- یکی از زنجیره ها دارای دو مارپیچ α است در حالی که زنجیره های دیگر دارای یک مارپیچ α و دو ورق β هستند.
- توالی اسیدهای آمینه در انسولین به شدت حفظ شده است و بین گونه های مختلف فقط کمی متفاوت است.
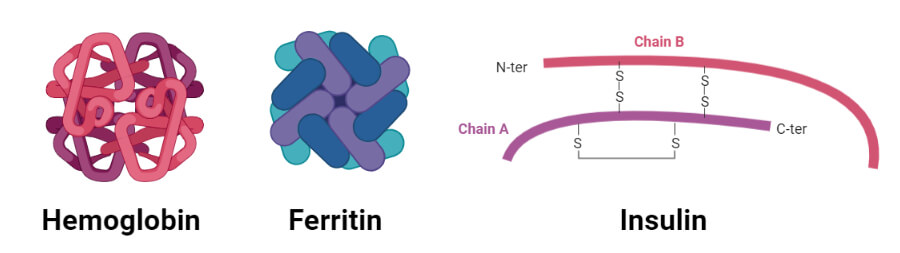
3. پپسین
- پپسین آنزیمی است که پروتئین ها را به پپتیدها یا اسیدهای آمینه کوچکتر تجزیه می کند.
- این یکی از سه پروتئاز مهم در بدن انسان به همراه تریپسین و کیموتریپسین است.
- پپسین توسط سلول های دیواره معده به شکل پپسینوژن آزاد می شود که پس از مخلوط شدن با اسید هیدروکلریک به پپسین تبدیل می شود.
- ساختار ثانویه غالب در پپسین صفحات β به همراه شش مارپیچ α راست دست است.
- پپسین همچنین بخشی از مایه پنیر است که برای بستن شیر در هنگام تولید پنیر استفاده می شود.
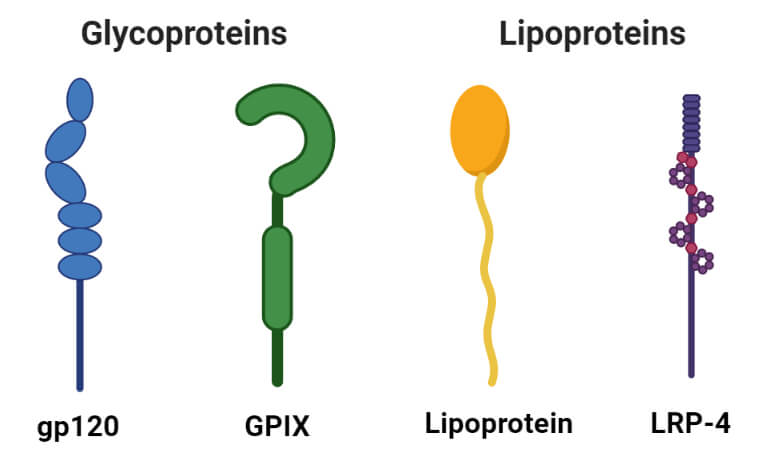
پروتئین های مزدوج
- گلیکوپروتئین ها
- لیپوپروتئین ها
1. گلیکوپروتئین ها
گلیکوپروتئین ها پروتئین های حاوی کربوهیدرات به عنوان یک گروه مصنوعی هستند. آنها حاوی مقادیر کمی کربوهیدرات (معمولا کمتر از 4٪) هستند. گلیکوپروتئین ها به عنوان پروتئین های جدایی ناپذیر مهم در غشاهای بیولوژیکی مختلف عمل می کنند که به تعاملات سلول-سلول کمک می کنند.
ایمونوگلوبولین ها گلیکوپروتئین های مهم سیستم ایمنی هستند که به عنوان آنتی بادی عمل می کنند و در برابر آنتی ژن ها محافظت می کنند. به طور مشابه، گلیکوپروتئین های محلول نیز در آلبومین تخم مرغ و پلاسمای خون یافت می شوند.
2. لیپوپروتئین ها
لیپوپروتئین ها پروتئین هایی هستند که با لیپیدهایی مانند سفالین، لسیتین و کلسترول کمپلکس تشکیل می دهند. اینها در آب محلول هستند اما در حلالهای آلی نامحلول هستند. لیپوپروتئین ها به عنوان واسطه های موقت در فرآیند انتقال لیپیدها از محل جذب به محل استفاده عمل می کنند.
دناتوره شدن پروتئین
دناتوره شدن پروتئین فرآیند تخریب ساختارهای چهارم، سوم و ثانویه پروتئین ها با اعمال نیروی خارجی یا مواد شیمیایی قوی مانند اسید و باز است.
دناتوره شدن پروتئین ممکن است فعالیت سلولی را از بین ببرد زیرا بسیاری از مسیرهای متابولیک به پروتئین در یک شکل یا شکل دیگر نیاز دارند. پس از دناتوره شدن، پروتئین ها طیف وسیعی از خواص مانند تغییر ساختار و از دست دادن حلالیت را نشان می دهند. پیوندهای هیدروژنی مسئول ساختار سوم پروتئین ها ضعیف هستند و به راحتی با گرما و تشعشع می شکنند. با این حال، دناتوراسیون بر ساختار اولیه پروتئین ها تأثیر نمی گذارد. در برخی موارد، دناتورهسازی برگشتپذیر است و پروتئینها میتوانند پس از حذف عامل استرس، شکل اصلی خود را به دست آورند. با این حال، برخی از موارد دناتوره شدن غیر قابل برگشت هستند.
نقش و عملکرد پروتئین ها
پروتئین ها مولکول های زیستی ضروری هستند که برای زندگی و انجام فعالیت های مختلف حیاتی هستند. برخی از نقش های بیولوژیکی مهم پروتئین ها عبارتند از:
- بسیاری از پروتئین ها به عنوان کاتالیزور عمل می کنند که سرعت واکنش های شیمیایی را در مسیرهای متابولیکی مختلف افزایش می دهد.
- پروتئینهای فیبری جزئی از بافتهای مختلف هستند که عناصر اسکلتی را مانند کلاژن، که یک واحد ساختاری از بافتهای همبند است، در کنار هم نگه میدارند.
- نوکلئوپروتئین ها به عنوان حامل ویژگی های ژنتیکی عمل می کنند و از این رو بر وراثت صفات حکومت می کنند.
- پروتئین ها همچنین عملکردهای انتقالی را انجام می دهند که حمل و نقل بسیاری از ترکیبات را به داخل و خارج سلول ها تنظیم می کند.
- هورمون های پروتئینی مختلف علاوه بر کنترل بسیاری از عملکردهای فیزیولوژیکی دیگر، رشد گیاهان و حیوانات را تنظیم می کنند.
- پلاسمای خون دارای پروتئین های محلول متعددی است که می توان از آنها برای درمان شوک ناشی از جراحات و عمل های شدید استفاده کرد.
- اینترفرون ها گلیکوپروتئین های تنظیمی هستند که توسط بسیاری از سلول های یوکاریوتی در پاسخ به عفونت ویروسی، اندوتوکسین ها، محرک های آنتی ژنی و بسیاری از ارگانیسم های انگلی تولید می شوند.
- پپتیدهای انسان به نام دفنسین ماهیت آنتی بیوتیکی دارند.
----------------------------------------------------------------------------------------------------------
پروتئین ها زنجیرههای بلندی از اسیدهای آمینه هستند که یک زنجیره مولکولی را تشکیل میدهند. در این مقاله به انواع مختلف پروتئینها و عملکرد و نحوه طبقه بندی آنها خواهیم پرداخت. با توجه به مطالعات انجام شده در این باره وظیفه اصلی همه پروتئینها ساختن بافتها در بدن ما با اتصال سلولها به یکد یگر از طریق پیوندهای پپتیدی آن است.
پروتئینها دارای چهار سطح هستند که میتوانند وجود داشته باشند: ساختار اولیه، ثانویه، سوم و چهارم. ساختار اولیه به ترتیب/توالی بقایای اسیدهای آمینه در ستون فقرات پلی پپتیدی اشاره دارد. در حالی که ساختار ثانویه شامل پیوند هیدروژنی بین اتمها است که باعث چینخوردگی یا خمش میشود مانند: تشکیل رشته آلفا هلیکس یا بتا. ساختار سوم شکل سه بعدی پروتئینها را توصیف میکند در حالی که ساختار کواترنر به تشکیل کمپلکسها بین دو یا چند زنجیره پلی پپتیدی مربوط میشود.
عملکرد پروتئینها در بدن
بدن ما از هزاران پروتئین مختلف تشکیل شده است که هر کدام عملکرد خاصی دارند. آنها اجزای ساختاری سلولها و بافتهای ما و همچنین بسیاری از آنزیمها، هورمونها و پروتئینهای فعال ترشح شده از سلولهای ایمنی را میسازند.
این پروتئینهای بدن بهطور مداوم در طول زندگی ما در حال ترمیم و جایگزینی هستند. این فرآیند (معروف به “سنتز پروتئین”) نیاز به تامین مداوم اسیدهای آمینه دارد. اگرچه برخی از اسیدهای آمینه را میتوان از تجزیه پروتئینهای قدیمی بدن بازیافت کرد، این فرآیند ناقص است. این بدان معناست که ما باید پروتئین رژیمی بخوریم تا با نیاز بدن به آمینو اسیدها سازگاری داشته باشیم. از آنجایی که پروتئین برای رشد سلولها و بافتها ضروری است، مصرف کافی پروتئین به ویژه در دورههای رشد سریع یا افزایش تقاضا، مانند دوران کودکی، نوجوانی، بارداری و شیردهی اهمیت دارد.
انواع پروتئین
بزرگترین دسته پروتئینها پروتئینهای ساختاری هستند. این انواع پروتئین به عنوان اجزای ضروری برای ساخت بدن شما عمل میکنند. کراتین و کلاژن رایجترین پروتئینهای ساختاری هستند. اینها پروتئینهای قوی و فیبری هستند. کراتین ساختار پوست، ناخن، مو و دندان شما را تشکیل میدهد. در حالی که کلاژن به عنوان یک ساختار پیوندی برای تاندونها، استخوانها، ماهیچهها، غضروف و پوست شما بهویژه عمل میکند.
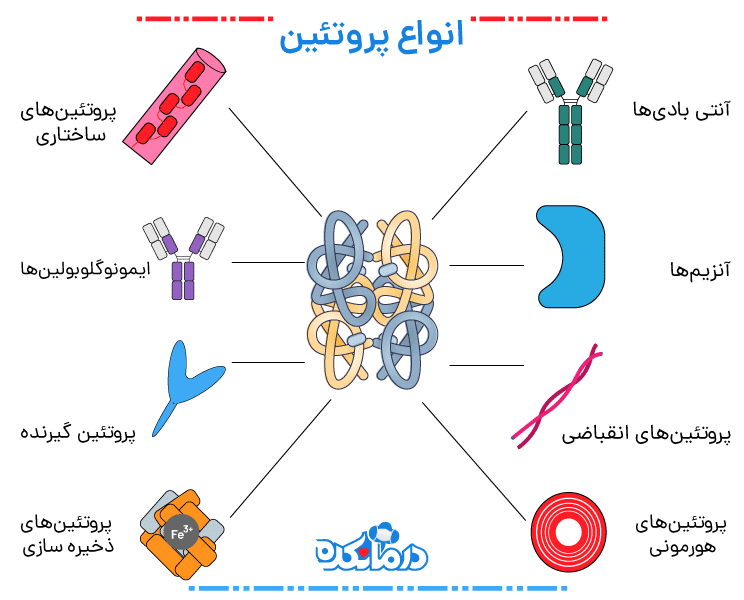
آنتی بادیها
آنتی بادیها پروتئینهای تخصصی هستند که از بدن در برابر آنتی ژنها یا مهاجمان خارجی دفاع میکنند. توانایی آنها در حرکت در جریان خون باعث میشود که سیستم ایمنی از آنها برای شناسایی و دفاع در برابر باکتریها، ویروسها و سایر عوامل خارجی موجود در خون استفاده کند. یکی از راههایی که آنتیبادیها با آنتیژنها مقابله میکنند، بیحرکت کردن آنها است تا بتوانند توسط گلبولهای سفید خون از بین بروند.
پروتئینهای انقباضی
پروتئینهای انقباضی مسئول انقباض و حرکت عضلات هستند. نمونههایی از این پروتئینها عبارتاند از اکتین و میوزین. یوکاریوتها تمایل به داشتن مقادیر زیادی اکتین دارند که انقباض عضلانی و همچنین حرکت سلولی و فرآیندهای تقسیم را کنترل میکند. میوزین وظایف انجام شده توسط اکتین را با تامین انرژی آن نیرو میدهد.
آنزیمها
آنزیمها پروتئینهایی هستند که واکنشهای بیوشیمیایی را تسهیل و سرعت میبخشند، به همین دلیل است که اغلب به عنوان کاتالیزور شناخته میشوند. آنزیمهای قابلتوجه شامل لاکتاز و پپسین، پروتئینهایی هستند که برای نقشهایشان در بیماریهای گوارشی و رژیمهای غذایی خاص آشنا هستند. عدم تحمل لاکتوز ناشی از کمبود لاکتاز است، آنزیمی که قند لاکتوز موجود در شیر را تجزیه میکند.
پپسین یک آنزیم گوارشی است که در معده برای تجزیه پروتئینهای موجود در غذا کار میکند کمبود این آنزیم منجر به سوءهاضمه میشود. نمونههای دیگر آنزیمهای گوارشی آنزیمهای موجود در بزاق هستند: آمیلاز بزاق، کالیکرئین بزاق و لیپاز لینگوال همگی عملکردهای بیولوژیکی مهمی را انجام میدهند. آمیلاز بزاق آنزیم اولیه موجود در بزاق است و نشاسته را به قند تجزیه میکند.
پروتئینهای هورمونی
پروتئینهای هورمونی پروتئینهای پیام رسان هستند که به هماهنگ کردن عملکردهای خاص بدن کمک میکنند. به عنوان مثال میتوان به انسولین، اکسی توسین و سوماتوتروپین اشاره کرد. انسولین با کنترل غلظت قند خون در بدن متابولیسم گلوکز را تنظیم میکند، اکسی توسین انقباضات را در هنگام زایمان تحریک میکند و سوماتوتروپین یک هورمون رشد است که تولید پروتئین در سلولهای ماهیچهای را تحریک میکند.
پروتئینهای ساختاری
پروتئینهای ساختاری فیبری و رشتهای هستند، این ساختار آنها را برای حمایت از پروتئینهای مختلف دیگر مانند کراتین، کلاژن و الاستین ایدهآل میکند. کراتینها پوششهای محافظی مانند: پوست، مو، پر، شاخ و منقار را تقویت میکنند. کلاژن و الاستین از بافتهای همبند مانند: تاندونها و رباطها حمایت میکنند.
پروتئینهای ذخیره سازی
پروتئینهای ذخیرهسازی اسیدهای آمینه را برای بدن ذخیره میکنند تا زمانی که برای استفاده آماده شوند. نمونههایی از پروتئینهای ذخیرهسازی عبارتانداز: اووالبومین، که در سفیده تخممرغ یافت میشود، و کازئین، پروتئینی مبتنی بر شیر. فریتین پروتئین دیگری است که آهن را در پروتئین هموگلوبین ذخیره میکند.
ایمونوگلوبولینها
بدن شما باید از خود در برابر مهاجمان و سایر مواد خارجی محافظت کند. ایمونوگلوبولی ها به این منظور عمل میکنند. آنها به عنوان آنتی بادی عمل میکنند و در پاسخ به شناسایی آنتی ژن آزاد میشوند. هر ایمونوگلوبولین در برابر یک نوع آنتی ژن مختلف محافظت میکند. ایمونوگلوبولین A در برابر آنتی ژن های مخاطی محافظت میکند. به عنوان مثال، اینها باکتریها یا ویروسهایی هستند که در بزاق شما یافت میشوند.
پروتئین گیرنده
پروتئینهای گیرنده که در قسمت بیرونی سلولها قرار دارند، موادی را که وارد سلولها و خارج میشوند. از جمله آب و مواد مغذی را کنترل میکنند. برخی از گیرندهها آنزیمها را فعال میکنند، در حالی که برخی دیگر غدد درون ریز را تحریک میکنند تا اپی نفرین و انسولین ترشح کنند تا سطح قند خون را تنظیم کنند.
ساختار
پروتئینها از آمینو اسیدهای مختلف که به هم مرتبط هستند ساخته شدهاند. بیست نوع مختلف از این واحدهای سازنده اسید آمینه وجود دارد که معمولاً در گیاهان و حیوانات یافت میشود. یک پروتئین معمولی از 300 یا بیشتر اسید آمینه تشکیل شده است و تعداد و دنباله خاصی از اسیدهای آمینه برای هر پروتئین منحصر به فرد است. بسته به تعداد و توالی اسیدهای آمینه، پروتئین حاصل به شکل خاصی قرار میگیرد.
این شکل بسیار مهم است زیرا عملکرد پروتئین (مانند ماهیچه یا آنزیم) را تعیین میکند. هر گونه، از جمله انسان، پروتئینهای مشخصه خود را دارد. اسیدهای آمینه به دو دسته ضروری یا غیر ضروری طبقهبندی میشوند. همانطور که از نام آن پیداست، اسیدهای آمینه ضروری توسط بدن تولید نمیشوند و بنابراین باید از رژیم غذایی ما تامین شوند. در حالی که آمینو اسیدهای غیر ضروری میتوانند توسط بدن تولید شوند و بنابراین نیازی به تهیه آنها از رژیم غذایی نیست.
اهمیت پروتئین
پروتئین یکی از اجزای سازنده اصلی بدن است که به رشد و ترمیم بافتها کمک میکند و در عین حال به عملکرد صحیح هورمونها و سیستم ایمنی بدن کمک میکند. پروتئین از اسیدهای آمینه تشکیل شده است که بدن انسان به 20 اسید آمینه نیاز دارد. بدن ما میتواند 11 مورد از این اسیدهای آمینه (که به عنوان اسیدهای آمینه “غیرضروری” یا “غیرقابل مصرف” شناخته میشوند، بسازد، بنابراین خوردن آنها غیرضروری است.
با اینحال، 9 عدد آمینو اسید وجود دارد که بدن ما نمیسازد ، به این معنی که ما باید آنها را در رژیم غذایی خود بگنجانیم. مهم این است که اکثر مردم برای تامین نیاز روزانه خود به پروتئین زیادی نیاز ندارند، تا حدی به این دلیل که بدن ما پروتئین را به طور بسیار موثر بازیافت میکند و سایر مواد مغذی را به عنوان سوخت برای ورزش ترجیح میدهد، به ویژه کربوهیدراتها، در واقع، یک انسان معمولی تقریباً دو برابر پروتئین مورد نیاز واقعی خود مصرف میکند. از سوی دیگر، ورزشکاران و سایر افرادی که به طور منظم ورزش یا تمرین میکنند، اغلب به پروتئین بیشتری نسبت به افراد معمولی نیاز دارند تا بتوانند به درستی از بارهای فعالیت بالاتر ترمیم و بازیابی شوند.
نکته مهم و طلایی در مورد پروتئین
- پروتئین برای سلامتی ما بسیار مهم است، نه تنها برای ساختن عضلات بزرگتر، بلکه برای بهبودی بهتر از آسیب، افزایش سن و جلوگیری از برخی بیماریها. به همین دلیل است که MEND Regenerate حاوی ترکیبی از سه پروتئین با کیفیت بالا است که به طور خاص برای کمک به هضم، افزایش سنتز پروتئین و جلوگیری از تجزیه پروتئین و در عین حال تحویل طولانیمدت اسیدهای آمینه به عضلات اسکلتی انتخاب شدهاند. اما پروتئین یک اندازه مناسب برای همه نیست، و مهم است که انواع مختلف پروتئین، میزان مورد نیاز و نحوه پردازش پروتئین را در بدنتان درک کنید تا بتوانید خود را برای بهبودی مناسب و سالمترین زندگی خود آماده کنید.
ارزش غذایی پروتئین چقدر است؟
در ابتدا بهتر است بدانید که ارزش غذایی یک پروتئین با مقدار اسیدهای آمینه ضروری آن اندازهگیری میشود. غذاهای مختلف حاوی مقادیر متفاوتی از اسیدهای آمینه ضروری هستند. بهطور کلی:
- محصولات حیوانی (مانند: مرغ، گوشت گاو یا ماهی و محصولات لبنی) دارای تمام اسیدهای آمینه ضروری هستند و به عنوان پروتئین “کامل” (یا پروتئین ایدهآل یا با کیفیت بالا) شناخته میشوند.
- محصولات سویا، کینوا و دانههای سبز برگی به نام آمارانت (مصرف در آسیا و مدیترانه) نیز دارای تمام اسیدهای آمینه ضروری هستند.
- پروتئینهای گیاهی (لوبیا، عدس، آجیل و غلات کامل) معمولاً فاقد حداقل یکی از اسیدهای آمینه ضروری هستند و پروتئینهای «ناقص» در نظر گرفته میشوند.
بنابراین افرادی که از یک رژیم گیاهخواری یا وگان پیروی میکنند باید هر روز منابع پروتئینی مختلفی را از ترکیبی از غذاهای گیاهی انتخاب کنند تا مطمئن شوند که ترکیب کافی از اسیدهای آمینه ضروری را دریافت میکنند. لازم به ذکر است که اگر از رژیم گیاهخواری یا وگان پیروی میکنید، تا زمانی که غذاهای متنوعی میخورید، معمولاً میتوانید پروتئین مورد نیاز خود را دریافت کنید. به عنوان مثال، یک وعده غذایی حاوی غلات و حبوبات، مانند: لوبیا پخته شده روی نان تست، تمام اسیدهای آمینه ضروری موجود در یک غذای گوشتی معمولی را فراهم میکند.

چگونه پروتئین مورد نیاز خود را تامین کنیم؟
نیاز روزانه شما به پروتئین را میتوان به راحتی با پیروی از برنامههای رژیم غذایی مناسب تامین کرد. دستورالعملها غذاها را به 5 گروه مختلف غذایی دسته بندی میکنند که هر کدام مواد مغذی مهم و کلیدی را ارائه میدهند.
2 گروه غذایی اصلی که به پروتئین کمک میکنند عبارتاند از:
- گروه “گوشت و مرغ بدون چربی، ماهی، تخم مرغ، آجیل و دانهها و حبوبات/لوبیا”
- گروه «شیر، ماست، پنیر و/یا جایگزینها (عمدتاً کمچربی)».
به عنوان بخشی از یک رژیم غذایی سالم، دستورالعملها وعدههای خاصی را در روز از هر یک از 5 گروه غذایی توصیه میکنند. چرا که بدن انسان نمیتواند پروتئین را ذخیره کند و مازاد آن را دفع میکند، بنابراین موثرترین راه برای تامین نیاز روزانه به پروتئین، خوردن مقادیر کم در هر وعده غذایی است. غذاهای توصیه شده روزانه از «گوشت بدون چربی و مرغ، ماهی، تخم مرغ، توفو، آجیل و دانه ها و حبوبات/لوبیا» و «شیر، ماست، پنیر و/یا جایگزین (عمدتاً با چربی کم)»
بنابراین، استاندارد چیست؟
اندازه استاندارد “گوشت و مرغ بدون چربی، ماهی، تخم مرغ، آجیل و دانهها، و حبوبات/لوبیا” موارد زیر است:
- 65 گرم گوشت بدون چربی پخته شده مانند گوشت گاو، بره، گوساله، خوک، بز یا کانگورو
- 80 گرم مرغ بدون چربی پخته شده مانند مرغ یا بوقلمون
- 100 گرم فیله ماهی پخته شده (حدود 115 گرم وزن خام) یا یک قوطی کوچک ماهی
- 2 عدد تخم مرغ بزرگ
- 1 فنجان (150 گرم) لوبیا خشک پخته شده، عدس، نخود، نخود خرد شده یا لوبیا کنسرو شده (ترجیحا بدون نمک اضافه شده)
- 30 گرم مغزها، دانهها، کره بادام زمینی یا بادام یا سایر مغزها یا خمیر دانه (بدون نمک اضافه).
یک وعده «شیر، ماست، پنیر و/یا جایگزینها (عمدتاً با چربی کمشده)» میتواند شامل موارد زیر باشد:
- 250 میلی لیتر (1 فنجان) تازه، با عمر طولانی UHT، شیر خشک یا دوغ
- 120 میلی لیتر (1/2 فنجان) شیر پخته شده
- 200 گرم (3/4 فنجان) ماست
- 40 گرم (2 برش) پنیر سفت مانند چدار
- 120 گرم (1/2 فنجان) پنیر ریکوتا.
توجه داشته باشید که: نیاز به پروتئین برای کودکان و نوجوانان با رشد آنها تغییر میکند.

اگر به دنبال راههایی برای دریافت پروتئین بیشتر در رژیم غذایی خود هستید، چند پیشنهاد ارائه میشود:
- ساندویچ کره بادام زمینی را امتحان کنید. به یاد داشته باشید که از کره بادام زمینی طبیعی بدون نمک، شکر یا سایر مواد پرکننده استفاده کنید.
- پنیر کوتیج یا ریکوتا کم چرب سرشار از پروتئین است و میتواند در تخم مرغهای همزده، پوره سیب زمینی یا ماکارونی شما بخورد. یا صبح آن را روی نان تست خود بمالید.
- آجیل و دانهها در سالادها، همراه با سبزیجات سرو شوند، فوق العاده هستند. سعی کنید مقداری آجیل یا بادام پرک شده را برشته کرده و در سالاد سبز خود بریزید.
- لوبیاها در سوپ، و سس پاستا عالی هستند. سعی کنید یک قوطی آبکش شده از لوبیا را در دستور پخت سوپ سبزیجات مورد علاقه خود قرار دهید.
- ماست یونانی یک ماده غذایی غنی از پروتئین است که میتوانید در طول روز از آن استفاده کنید. مقداری به غلات صبحانه مورد علاقه خود اضافه کنید، یک قاشق را روی یک کاسه سوپ کدو تنبل قرار دهید یا آن را به عنوان دسر با مقداری میوه تازه سرو کنید.
- تخم مرغ یک گزینه در دسترس و آسان است که میتوان آن را به تنهایی میل کرد یا در غذاهای مختلف مخلوط کرد.
آیا بین پروتئینهای حیوانی و گیاهی تفاوتی وجود دارد؟
همانطور که در مباحث پیشین نیز به آن اشاره شد، هم غذاهای حیوانی و هم غذاهای گیاهی میتوانند منابع غنی پروتئین باشند. اما آیا کیفیت یکسانی دارند؟
کیفیت یک پروتئین را میتوان به روشهای مختلفی تعریف کرد. با این حال، همه تعاریف مربوط به توزیع و نسبت اسیدهای آمینه ضروری و غیر ضروری آنها است. به طور کلی، پروتئینهای حیوانی از کیفیت بالاتری برخوردار هستند زیرا حاوی نسبتهای بالاتری از اسیدهای آمینه ضروری در مقایسه با پروتئینهای گیاهی هستند.
یک تصور غلط رایج وجود دارد که پروتئینهای گیاهی به طور کامل فاقد اسیدهای آمینه ضروری خاص هستند. در واقع، بیشتر پروتئینهای گیاهی حاوی تمام 20 اسید آمینه هستند، اما تمایل دارند مقدار محدودی از اسیدهای آمینه ضروری خاص را داشته باشند که به عنوان اسیدهای آمینه محدود کننده شناخته میشوند.
این بدان معناست که اگر تعداد کمی از غذاهای گیاهی به عنوان تنها منبع پروتئین مصرف شود، بعید است که آمینو اسیدهای ضروری کافی را برای برآورده کردن نیازهای ما تامین کنند. برای افرادی که غذاهای حیوانی مصرف نمیکنند، مانند وگان ها یا گیاهخواران، مهم است که پروتئین را از منابعی با اسیدهای آمینه محدود کننده مکمل مصرف کنند. به عنوان مثال، مصرف برنج و لوبیا آمینو اسیدهای مکمل را فراهم میکند که میتواند به تامین نیازهای اسید آمینه ضروری کمک کند.
کمبود آن چه تاثیری بر بدن دارد؟
کمبود پروتئین برای مردم کشورهای ثروتمندتر اتفاقی بسیار نادر است. بر اساس بررسی مقالات علمی منتشر شده در مجله Nutrients، حتی گیاهخواران و وگانها معمولاً بیش از مقدار توصیه شده روزانه پروتئین دریافت میکنند.
با این حال، نوعی از سوءتغذیه به نام کواشیورکور میتواند در مکانهایی که قحطی، بلایای طبیعی یا سایر اختلالات در عرضه مواد غذایی را تجربه میکنند، ایجاد شود. علائم کواشیورکور که به دلیل نداشتن پروتئین کافی در رژیم غذایی ایجاد می شود عبارتاند از:
- شکم بزرگ و بیرون زده
- کاهش توده عضلانی
- اسهال
- عدم افزایش وزن و رشد در کودکان
- خستگی
- رنگ پریدگی و زرد شدن رنگ پوست
- تغییر در رنگ یا بافت مو
- افزایش و شدت عفونتها
- تحریک پذیری
- تورم مچ پا
با درمان اولیه تغذیه، کودکان مبتلا به کواشیورکور میتوانند به طور کامل بهبود یابند. با این حال، در صورت درمان، اختلالات جسمی و روانی دائمی ممکن است رخ دهد. اگر درمان خیلی دیر انجام شود، شوک، کما و مرگ میتواند منجر شود.
فواید پروتئین برای سلامتی چیست؟
خوردن پروتئین کافی برای تامین نیازهای بدن برای بسیاری از عملکردهای بدن مهم است. با این حال، شواهدی وجود دارد که نشان میدهد در شرایط خاص افزایش مصرف پروتئین بالاتر از سطح مورد نیاز میتواند مزایای سلامتی بیشتری را به همراه داشته باشد.
حفظ توده عضلانی با افزایش سن
از حدود 50 سالگی، انسان شروع به از دست دادن تدریجی ماهیچههای اسکلتی میکند. این به عنوان سارکوپنی شناخته میشود و در افراد مسن شایع است. از دست دادن توده عضلانی با بیماری مزمن، رژیم غذایی نامناسب و عدم تحرک بدتر میشود. دریافت پروتئین توصیه شده روزانه ممکن است به شما در حفظ توده عضلانی و قدرت کمک کند. این برای حفظ توانایی شما در راه رفتن و کاهش خطر آسیب ناشی از سقوط مهم است. برای حفظ توده عضلانی، برای افراد مسن مهم است که پروتئین را “موثر” مصرف کنند. این به معنای مصرف غذاهای پروتئینی با کیفیت بالا، مانند گوشت بدون چربی است.
کنترل وزن با مصرف پروتئین
ثابت شده است که خوردن غذاهای غنی از پروتئین باعث افزایش احساس سیری بیشتر از غذاهای پر چرب یا کربوهیدرات میشود. شواهد خوبی از مطالعات کوتاهمدت وجود دارد که رژیمهای غذایی سرشار از پروتئین (یعنی 1.2 تا 1.6 گرم بر کیلوگرم در روز؛ 84 تا 112 گرم در روز برای بزرگسالان 70 کیلوگرمی) میتوانند به کاهش دریافت کالری کلی و کاهش وزن کمک کنند. با این حال، شواهد مربوط به حفظ وزن دراز مدت کمتر روشن است. مانند همه رژیمها، رژیم غذایی با پروتئین بالا تنها در صورتی مؤثر است که به آن پایبند باشد، که برای برخی افراد میتواند دشوار باشد و پایبندی کم ممکن است تا حدی مزایای محدودی به دنبال داشته باشد.
جلوگیری از ابتلا به برخی از اختلالات
سارکوپنی یک اختلال است که با از دست دادن پیشرونده توده عضلانی و عملکرد فیزیکی مشخص میشود که معمولاً در افراد مسن مرتبط است. سارکوپنی با افزایش ضعف، خطر افتادن، زوال عملکرد و حتی مرگ زودهنگام همراه است. از آنجایی که پروتئین برای ترمیم و حفظ توده عضلانی ضروری است، تعجبی ندارد که مصرف کم پروتئین با افزایش خطر ابتلا به سارکوپنی مرتبط باشد. به طور مشابه، افزایش مصرف پروتئین و همچنین افزایش فعالیت بدنی میتواند به حفظ توده عضلانی و قدرت با افزایش سن کمک کند و خطر سارکوپنی و اختلالات اسکلتی را کاهش دهد.
تاثیر مثبت بر روی عملکرد ورزشی
پروتئین از دیرباز با عملکرد ورزشی مرتبط بوده است. پروتئین نقش کلیدی در کمک به ترمیم و تقویت بافت عضلانی پس از ورزش دارد. اگرچه پروتئین برای عضله سازی حیاتی است، اما برای به حداکثر رساندن فواید آن باید در کل رژیم غذایی که شامل مقدار مناسب کربوهیدرات، چربی، ویتامین و مواد معدنی است، در نظر گرفته شود.
مصرف بهینه پروتئین به نوع (مثلاً تمرینات استقامتی یا مقاومتی)، مدت و شدت تمرین بستگی دارد، در حالی که بیشتر آن همیشه بهتر نیست. تصور میشود مصرف پروتئین 1.4 تا 2.0 گرم به ازای هر کیلوگرم وزن بدن در روز (مثلاً 98 تا 140 گرم در روز برای بزرگسالان 70 کیلوگرمی) برای رفع نیازهای بیشتر افراد ورزشکار کافی است. از طریق مصرف یک رژیم غذایی متعادل، با مکملهای پروتئینی برای افرادی که نیاز به حفظ پروتئین بالا و محدود کردن کالری دریافتی دارند، استفاده میشود.
تاثیرات منفی مصرف بیش از حد آن چیست؟
شواهد کافی برای تعیین آستانه برای دریافت پروتئین وجود ندارد و EFSA بیان کرده است که دریافت پروتئین دو برابر DRV (1.7 گرم بر کیلوگرم در روز یا 119 گرم در روز برای یک بزرگسال 70 کیلوگرمی) هنوز در شرایط عادی بیخطر تلقی میشود. برای افراد مبتلا به بیماری کلیوی، پروتئین بیش از حد میتواند یک مشکل باشد و این افراد باید قبل از افزایش سطح پروتئین با یک متخصص تغذیه مشورت کنند.
افزایش وزن
یک تصور غلط رایج وجود دارد که شما نمیتوانید با خوردن پروتئین وزن اضافه کنید. این درست نیست، درست مانند کربوهیدراتها و چربیها، وقتی در طول کالری مازاد مصرف میشود، پروتئین اضافی میتواند به چربی بدن تبدیل شود و منجر به افزایش وزن شود. وقتی صحبت از حفظ وزن میشود، مهمترین چیز حفظ تعادل انرژی است.
گوشت قرمز و فرآوری شده و خطر سرطان
پروتئین برای سلامتی ضروری است، اما برخی از غذاهای پر پروتئین ممکن است برای سلامتی ما بهتر از سایرین باشند. به طور خاص، مصرف مقادیر زیاد گوشت قرمز و فرآوری شده با افزایش خطر ابتلا به برخی سرطانها مرتبط است. گوشت قرمز منبع خوبی از پروتئین و همچنین بسیاری از مواد مغذی ضروری دیگر مانند آهن، ویتامین B12 و روی است. برای کاهش خطر، لزوماً نیازی به اجتناب از آنها نیست. صندوق جهانی تحقیقات سرطان توصیه میکند که سعی کنیم بیش از سه وعده (حدود 350 تا 500 گرم وزن پخته شده) گوشت قرمز در هفته مصرف نکنیم و گوشت فرآوریشده بسیار کم مصرف کنیم.
پایداری پروتئین
انتخابهای غذایی ما نه تنها بر سلامت ما تأثیر میگذارد بلکه بر محیط زیست نیز تأثیر میگذارد. به طور کلی، پروتئینهای حیوانی مانند: گوشت گاو، لبنیات و بره در مقایسه با منابع گیاهی مانند: سویا، نخود فرنگی و عدس تأثیر زیستمحیطی بالاتری دارند (یعنی از منابع بیشتری استفاده میکنند و گازهای گلخانهای بیشتری تولید میکنند). در حالی که اجتناب کامل از غذاهای حیوانی ضروری یا توصیه نمیشود، تغییر الگوهای غذایی برای گنجاندن بیشتر منابع پروتئینی گیاهی میتواند برای سلامتی ما و سیاره زمین مفید باشد.
روزانه چه مقدار غذا از گروه غذاهای پروتئینی مورد نیاز است؟
مقدار غذاهای پروتئینی که باید بخورید به سن، جنس، قد، وزن و سطح فعالیت بدنی شما بستگی دارد. برای زنان، مقدار آن میتواند به باردار بودن یا شیردهی شما نیز بستگی داشته باشد. اکثر افراد به اندازه کافی از گروه غذاهای پروتئینی میخورند، اما باید انواع گوشت و مرغ لاغرتر را انتخاب کنند و تنوع غذاهای پروتئینی انتخاب شده را افزایش دهند و گوشت را کمتر انتخاب کنند.
چرا انتخاب گزینههای متنوع از گروه غذاهای پروتئینی مهم است؟
غذاهای موجود در گروه غذاهای پروتئینی شامل گوشت، مرغ، تخم مرغ، غذاهای دریایی، آجیل، دانهها و محصولات سویا، مواد مغذی را فراهم میکنند که برای سلامت و حفظ بدن شما حیاتی هستند. بسیاری از افراد توصیههای پروتئین برای گوشت، مرغ و تخم مرغ را رعایت میکنند، اما توصیه های مربوط به غذاهای دریایی یا آجیل، دانهها و محصولات سویا را رعایت نمیکنند.
رعایت توصیهها برای این زیر گروههای غذاهای پروتئینی میتواند به افزایش مصرف مواد مغذی مهم از جمله چربیهای غیر اشباع، فیبر غذایی و ویتامین D کمک کند و به محدود کردن مصرف سدیم و چربیهای اشباع شده از گوشت و مرغ فرآوریشده کمک کند.
چرا خوردن انواع غذاهای دریایی در هفته مهم است؟
غذاهای دریایی حاوی طیف وسیعی از مواد مغذی، به ویژه اسیدهای چرب امگا 3، EPA و DHA هستند. خوردن حدود 8 اونس در هفته از انواع غذاهای دریایی، مقدار توصیه شده برای بسیاری از بزرگسالان، به عنوان بخشی از یک رژیم غذایی سالم، میتواند از سلامتی حمایت کند. برخی از انواع ماهیها مانند سالمون و قزل آلا نیز منابع طبیعی ویتامین D هستند، ماده مغذی که بسیاری از مردم به اندازه کافی از آن دریافت نمیکنند.
انواع غذاهای دریایی که معمولاً در ایالات متحده مصرف میشوند و دارای EPA و DHA بالاتر و نوعی جیوه کمتر هستند، به شکل متیل جیوه، شامل ماهی قزل آلا، صدف اقیانوس آرام و قزل آلا هستند. مقدار غذاهای دریایی توصیه شده بر اساس سن، وزن و سطح فعالیت بدنی متفاوت است.
سازمان غذا و داروی ایالات متحده و آژانس حفاظت از محیط زیست ایالات متحده توصیههای مشترکی را برای محدود کردن قرار گرفتن در معرض متیل جیوه از غذاهای دریایی برای زنان باردار یا شیرده و کودکان خردسال ارائه میدهند.
نتیجهگیری
پروتئین برای زندگی ضروری است. آمینو اسیدهای ضروری مورد نیاز برای رشد و نگهداری سلولها و بافتهای ما را تامین میکند. نیاز ما به پروتئین بستگی به مرحله زندگی ما دارد و بیشتر اروپاییها به اندازه کافی برای تامین نیازهای خود مصرف میکنند. از آنجایی که اکثر افراد رژیم غذایی متنوعی مصرف میکنند، کیفیت و قابلیت هضم پروتئینهایی که میخورند نباید نگران کننده باشد تا زمانی که کل مقدار پروتئین نیاز روزانه آنها را برآورده کند. همانطور که ما غذا میخوریم و نه مواد مغذی، باید غذاهای غنی از پروتئین را انتخاب کنیم که نه تنها آمینو اسیدهای ضروری را تامین میکنند، بلکه از یک رژیم غذایی سالم و پایدار نیز حمایت میکنند.