- سلولی و مولکولی
- 01. دوره جامع آزمایشگاه ژنتیک
- 02. دوره جامع کارآموزی مولکولی
- 03. دوره کارآموزی ارشد آزمایشگر
- 47. دوره آنالیز داده های NGS
- 05. دوره کارآموزی جامع کاربری دستگاه فلوسایتومتری
- 16. دوره طراحی پرایمر و اصول PCR
- 11. دوره کاربری دستگاه Real time PCR
- 46. دوره پژوهشگر شو
- 21. کارگاه QF-PCR
- 04.دوره کارآموزی جامع تکنسین آزمایشگاه ژنتیک (کاریوتایپ)
- 13. دوره جامع ارشد مهندسی ژنتیک (کلونینگ) و دوره جامع کشت سلول (رده سلول سرطانی)
- 08. دوره کشت سلول (رده سلول سرطانی)
- 15. کارگاه SDS-PAGE و وسترن بلات
- 17. دوره آنالیز کروموزوم های انسانی (مقدماتی و پیشرفته)
- 31. کارگاه معرفی تکنولوژی های ویرایش ژنوم یوکاریوتی با تاکید بر تکنولوژی مدرن CRISPR/Cas9
- میکروبیولوژی
- 09. دوره جامع ارشد مهندسی ژنتیک (کلونینگ)
- 20. کارگاه بیان، استخراج و تخلیص پروتئین از میزبان باکتریایی
- 23. نرم افزار های مولکولی
- 55. دوره کاربری دستگاه فرمانتور
- 56. دوره میکروب شناسی آزمایشگاه
- 57. ارزیابی بیان پروتئین نوترکیب
- 58. کارگاه تولید پروتئین تک سلولی
- 59. کارگاه آنالیز متابولیت های ثانویه در گیاهان دارویی
- نانو فناوری
- 45. دوره الکتروریسی
- 34. تولید نانو ذرات به روش میکروامولسیون
- 35. تولید نانو ذرات به روش آسیاب گلوله ای
- 36. تولید نانو ذرات به روش سل ژل
- 37. تولید نانو ذرات به روش هیدروترمال
- 38. متصدی تولید نانو لوله های کربنی با روش CVD
- 39. متصدی توليد نانو كامپوزيت های پايه پليمری گرما نرم
- 60. آزمایشگر ارشد کروماتوگرافی گازی
- زیست پزشکی
- 06. دوره مهندسی بافت
- 14. دوره ایمونوتراپی سرطان
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 19. کارگاه آنالیز داده های زیستی
- 48. کارگاه کاربری دستگاه الایزا
- 49. کارگاه جامع ساخت هیدروژل ها (تمام عملی)
- 50. کارگاه مهندسی حاملهای دارو رسان
- 51. کارگاه جامع زیستسازگاری و آزمونهای بیولوژیک
- 64. دوره ایمونوهیستوشیمی
- 65. دوره تکنیک های نوین علوم زیستی
- 66. کارگاه واکسن های نوترکیب
- آموزشی پژوهشی
- دوره های عمومی
- 07. دوره جامع کارآموزی در آزمایشگاه (پذیرش، نمونه گیری، تزریقات با سرنگ و ونوجکت، نسخه خوانی)
- 10. آموزش کنترل کیفی، استانداردسازی و مستندسازی آزمایشگاههای تشخیص پزشکی
- 18. کارگاه حیوانات آزمایشگاهی (موش و رات)
- 48. کارگاه کاربری دستگاه الایزا
- 32. دوره آنلاین WGCNA
- 61. دوره کاربر پایگاه های علوم زیستی
- 63. تحلیلگر آزمايشات علوم زيستی و بیوتکنولوژی با نرم افزار Minitab
- برنامه نویسی
- 25. دوره کامل مجازی آموزش برنامه نویسی پایتون (مقدماتی تا پیشرفته)
- 26. دوره آفلاین جامع برنامه نویسی R (مقدماتی و پیشرفته)
- 27. دوره آفلاین جامع برنامه نویسی پیشرفته R سطح ۱(TCGA)
- 28. دوره آفلاین برنامه نویسی پیشرفته R سطح 2: functional Enrichmet و نمودارها در R
- 29. دوره آفلاین برنامه نویسی پیشرفته R (دوره ی پیشرفته ی 3: GEO)
- 30. دوره آفلاین ceRNA
48. کارگاه کاربری دستگاه الایزا
آموزشگاه نانو زیست فناوری اوژن (تکوین)، اولین آموزشگاه رسمی فنی و حرفه ای در رشته نانو زیست فناوری در تهران برگزار میکند:
کارگاه کاربری دستگاه الایزا
سرفصل و محتوا:
✅ به كارگيري انواع تكنيك هاي ELISA وسيستم هاي تقويت كننده سيگنال
✅ به كارگيري انواع آنزيمها و معرف هاي مورداستفاده
✅ به کارگيري انواع تست ها و كيت هاي تجاري موجود
✅ كار با دستگاه ها و تجهيزات مورد استفاده در ELISA
✅ تجزيه و تحليل مراحل ELISA
✅ پردازش اطلاعات (رسم منحني كاليبراسيون)
✅ به كارگيري نكات عملي و رفع مشكل در تست ELISA
✅ به كارگيري ضوابط ايمني و بهداشتي در محيط كار
🔴ظرفیت محدود
🔴قیمت استثنایی
🔴همراه با ارائه گواهی مهارت آموزی از سازمان فنی و حرفه ای کشور
🍁پیشرفت هریک از شما پیشرفت ماست.🍁
❖ ── ✦ ──『✙ – ✙』── ✦ ── ❖
برای اطلاع از جزئیات ثبتنام و مشاوره میتوانید از طریق شمارهتلفن، واتساپ ،اینستاگرام، تلگرام و وبسایت آموزشگاه آزاد ژن فناوری اوژن اقدام کنید.
www.ogene-tech.com
tel: 021-44961487-09120169816
whats app: 09233093463
t.me/Ogenetechnology
@ogenetech
💫«مهارت شما آینده شماست»💫
دسته: دوره های زیست پزشکی
توضیحات
توضیحات
تست الایزا (ELISA) چیست|مراحل تکنیک الایزا
تست الایزا (ELISA) که مخفف (Enzyme-linked immunosorbent) میباشد، روشی برای تشخیص ایمنی و کشف بیماری های موجود در خون است. تست الایزا یک آزمایش ارزان و نسبتاً دقیق است و در آن یک نمونه خونی گرفته شده و در دور بالا سانتریفوژ میشود. پس از جداسازی سرم خون از ذرات٬ یک ماده معرف (کانژوگه) به سرم خون اضافه میشود که محلول را رنگی میکند و وجود پادتنهای ضد ویروس موردنظر را مشخص می سازد. تست الایزا را در حالت معمول برای ردیابی آنتی ژن یا آنتی بادی بکار می برند. بدین ترتیب که یکی از این دو ماده در بستر جامد ثابت شده و برای ردیابی دومی بکار گرفته می شود.
مراحل تست الایزا

۱- مرحله کوتینگ ( Coating):
شامل Coating آنتی ژن یا آنتی بادی اختصاصی در کف چاهک ها است که توسط کارخانه سازنده کیت انجام می شود.
۲- مرحله بلاکینگ (Blocking):
در این مرحله فضاهای خالی بین آنتی ژنها یا آنتی بادی های coat شده در کف چاهک، با یک پروتئین خنثی پر می شود. که توسط تولید کننده کیت انجام میگیرد. آلبومین سری گاوی از رایجترین بلاک کننده ها میباشد.
۳- مرحله سمپلینگ (Sampeling):
این مرحله از تست الایزا سرم بیمار و یا معرف های دیگر نظیر استانداردها و کنترلها، درون چاهک ها ریخته می شود.
۴- انکوباسیون (Incubation):
انکوباسیون به معنای مدت زمان مشخص در درجه حرارت مشخص میباشد. معمولا در دمای ۲۵ یا ۳۷ درجه صورت می گیرد.
در این فرآیند آنتی ژن ها و آنتی بادی های موجود در چاهک ها با هم واکنش نشان دهند.
۵- اضافه کردن معرف نشاندار (Conjugate):
این مرحله معرف نشاندار شده با آنزیم که به کانژوگه معروف است به منظور نشاندار کردن واکنش های آنتی ژن و آنتی بادی افزوده می شود.
۶- شستشو چاهک ها (Washing):
در این مرحله با محلول شستشوی کیت، درون چاهک ها شستشو داده میشود. تا آنتی ژن ها و آنتی بادی های غیر اختصاصی که در واکنش شرکت نکرده اند و OD کاذب ایجاد میکنند، از محیط چاهک ها تخلیه شوند. این مرحله توسط دستگاه الایزا واشر صورت می پذیرد.
۷- اضافه کردن سوبسترا (TMB-Substrate):
در این مرحله از تست الایزا یک معرف دیگر به چاهک ها اضافه می شود که سوبسترا نام دارد. سوبسترا با کانژوگه واکنش نشان داده و سبب تشکیل رنگ درون چاهک ها می گردد.
۸- اضافه کردن محلول استاپ (Stop) :
در ادامه تست الایزا یک معرف دیگر به نام Stop به چاهک ها اضافه می شود. این معرف سبب متوقف کردن واکنش آنزیمی و در نتیجه جلوگیری از افزایش رنگ درون چاهک ها می گردد.
۹- مرحله خوانش (Read):
در این مرحله میزان جذب محتوای چاهک ها به کمک دستگاه الایزا ریدر در طول موج های مشخص اندازه گیری می شود.
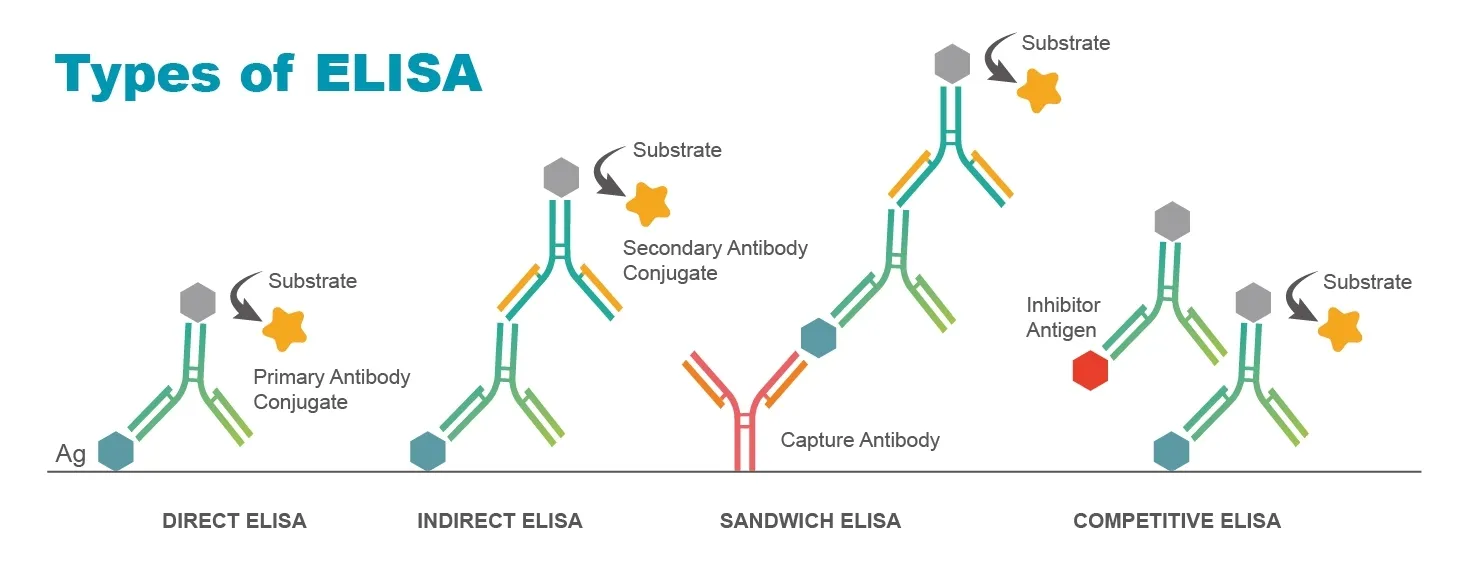
چهار نوع اصلی الایزا وجود دارد:
روش های الایزا به چهار روش تقسیم می گردد: الایزای مستقیم، الایزای غیرمستقیم، الایزای ساندویچی و الایزای رقابتی. هر کدام مزایا، معایب و مناسبت منحصر به فردی دارند.
الایزا مستقیم (Direct ELISA)
یکی از روش های الایزا، الایزا مستقیم نام دارد. این روش وجود آنتی ژن را در نمونه تشخیص می دهد. یک چاهک میکروتیتر ابتدا با یک آنتی بادی همولوگ مخصوص آنتی ژن مورد نظر پوشیده می شود. پس از آن چاهک را با یک عامل مسدود کننده پوشش می دهند تا از اتصال غیر اختصاصی اجزاء جلوگیری شود. نمونه مورد سنجش به چاهک اضافه می شود. اگر آنتی ژن وجود داشته باشد، با آنتی بادی پوشش دهنده چاهک واکنش نشان می دهد. اگر هیچ کدام وجود نداشته باشد، هیچ واکنشی رخ نمی دهد. در این شکل از ELISA، آنتی بادی متصل به آنزیم (کونژوگه) نیز برای آنتی ژن مورد نظر اختصاصی است. هنگامی که به چاهک اضافه می شود، در صورت وجود به آنتی ژن متصل می شود. پس از زمان دادن به آنتی بادی مرتبط با آنزیم برای واکنش با آنتی ژن، چاهک شسته می شود تا هرگونه آنتی بادی متصل به آنزیم (که با اضافه شدن سوبسترا مثبت کاذب ایجاد می کند) حذف شود. پس از افزودن سوبسترا، تغییر رنگ شاهدی بر تبدیل آنزیمی سوبسترا به محصول آن است که نشان دهنده وجود آنتی ژن است.
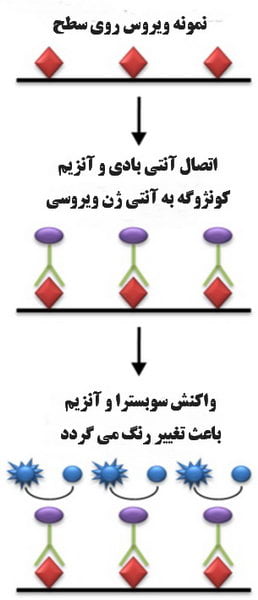
الایزای غیر مستقیم (Indirect ELISA)
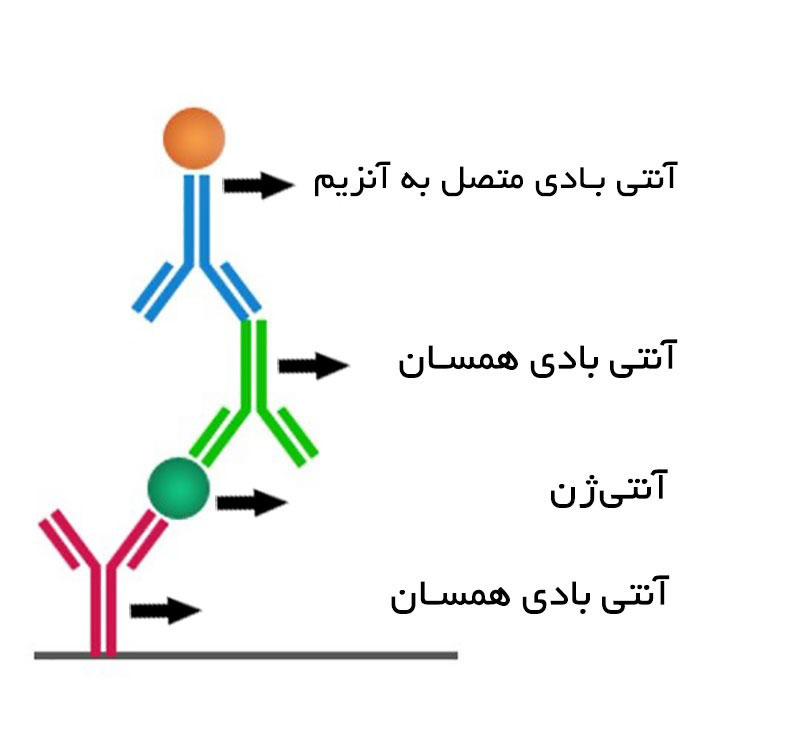
از دیگر روش های الایزا، تکنیک غیر مستقیم است که که از یک فرآیند دو مرحله ای برای تشخیص استفاده می کند، به موجب آن یک آنتی بادی اولیه مخصوص آنتی ژن به هدف متصل می شود و یک آنتی بادی ثانویه نشاندار شده علیه گونه میزبان آنتی بادی اولیه برای تشخیص به آنتی بادی اولیه متصل می شود. همانطور که برای سنجش مستقیم ELISA، آنتی ژن در سطح پلیت چند چاهکی بی حرکت می شود. این روش همچنین می تواند برای شناسایی آنتی بادی های خاص در نمونه سرم با جایگزینی سرم به جای آنتی بادی اولیه استفاده شود.
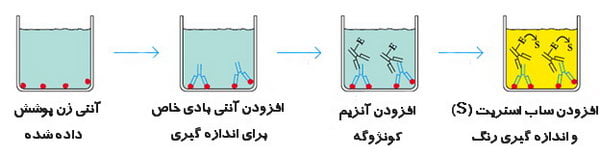
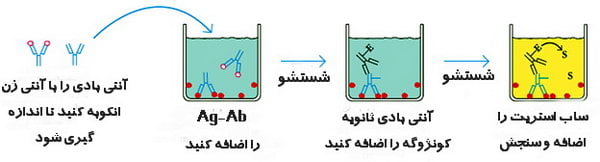
ساندویچ الایزا (Sandwich ELISA)
یکی از روش های الایزا، تکنیکی به عنوان الایزای رقابتی است. ساندویچ الایزا (یا ایمونواسی ساندویچ) رایج ترین فرمت مورد استفاده است. این فرمت به دو آنتی بادی خاص برای اپی توپ های مختلف آنتی ژن نیاز دارد. این دو آنتی بادی معمولاً به عنوان جفت آنتی بادی منطبق شناخته می شوند. یکی از آنتی بادی ها روی سطح پلیت چندچاهک پوشانده شده و به عنوان یک آنتی بادی جذب برای تسهیل بی حرکتی آنتی ژن استفاده می شود. آنتی بادی دیگر کونژوگه است و تشخیص آنتی ژن را تسهیل می کند. روش ساندویچ الایزا مرسوم ترین شیوه بین روش های الایزا محسوب می گردد. تصویر زیر یک گردش کار برای یک روش ELISA ساندویچ معمولی را نشان می دهد:
الایزای رقابتی (Competitive ELISA)
همچنین به عنوان ELISA مهاری یا ایمونواسی رقابتی شناخته می شود، سنجش های ELISA رقابتی غلظت یک آنتی ژن را با تشخیص تداخل سیگنال اندازه گیری می کنند. هر یک از قالب های قبلی را می توان با قالب رقابتی تطبیق داد. آنتی ژن نمونه برای اتصال به مقدار خاصی از آنتی بادی نشاندار شده با آنتی ژن مرجع رقابت می کند. آنتی ژن مرجع از قبل روی یک پلیت چندچاهک پوشانده شده و نمونه با آنتی بادی نشاندار شده از قبل انکوبه شده و به چاهکک ها اضافه می شود. بسته به مقدار آنتی ژن در نمونه، آنتی بادی های کم و بیش آزاد برای اتصال آنتی ژن مرجع در دسترس خواهند بود. این بدان معنی است که هر چه آنتی ژن در نمونه بیشتر باشد، آنتی ژن مرجع کمتری شناسایی می شود و سیگنال ضعیف تر می شود. برخی از کیت های رقابتی ELISA از آنتی ژن نشاندار به جای آنتی بادی نشاندار استفاده می کنند. آنتی ژن نشاندار شده و آنتی ژن نمونه (بدون برچسب) برای اتصال به آنتی بادی اولیه با هم رقابت می کنند. هرچه مقدار آنتی ژن در نمونه کمتر باشد، به دلیل آنتی ژن نشاندار بیشتر در چاهک، سیگنال قوی تر می شود.
مقایسه انواع روش های الایزا
| روش آزمایش الیزا | مزایا | معایب |
| الایزا مستقیم (Direct ELISA) | پروتکل کوتاه: باعث صرفه جویی در زمان و معرف ها می شود. عدم واکنش متقابل از آنتی بادی ثانویه. | زمینه بالقوه بالا: تمام پروتئین های نمونه به سطح متصل می شوند. بدون تقویت سیگنال انعطاف پذیری کم: آنتی بادی اولیه باید کونژوگه شود. |
| الایزای غیر مستقیم (Indirect ELISA) | تقویت سیگنال: چندین آنتی بادی ثانویه به آنتی بادی اولیه متصل می شوند. انعطاف پذیری بالا: همان آنتی بادی ثانویه ممکن است برای چندین آنتی بادی اولیه استفاده شود. | پروتکل طولانی اگر با الایزا مستقیم مقایسه شود. واکنش متقابل بالقوه از آنتی بادی ثانویه |
| ساندویچ الایزا (Sandwich ELISA) | اختصاصیت بالا: شامل دو آنتی بادی است که اپی توپ های مختلف را روی یک آنتی ژن یکسان تشخیص می دهند. مناسب برای نمونه های پیچیده انعطاف و حساسیت بالا: می توان از هر دو روش مستقیم و غیر مستقیم استفاده کرد. | طراحی سخت: یافتن دو آنتی بادی علیه یک هدف که اپی توپ های مختلف را تشخیص می دهند و به خوبی با هم کار می کنند، گاهی اوقات می تواند چالش برانگیز باشد. |
| الایزای رقابتی (Competitive ELISA) | بستگی به ELISA پایه انتخاب شده دارد. برای آنتی ژن های کوچک مناسب است. | بستگی به ELISA پایه انتخاب شده دارد |
طبقه بندی داده های الایزا
سنجش الایزا را می توان با توجه به نوع داده های به دست آمده به صورت زیر طبقه بندی کرد:
- الایزا کیفی فقط تعیین می کند که آیا آنتی ژن در نمونه وجود دارد یا نه. به یک چاهکک خالی بدون آنتی ژن یا یک آنتی ژن کنترل نامربوط نیاز دارد.
- ELISA نیمه کمی امکان مقایسه نسبی سطوح آنتی ژن بین نمونه ها را فراهم می کند.
- ELISA کمی امکان محاسبه مقدار آنتی ژن موجود در نمونه را فراهم می کند که نیاز به مقایسه مقادیر اندازهگیری شده برای نمونهها با یک منحنی استاندارد تهیهشده از رقتسازی سریالی یک آنتیژن خالصشده در غلظت مشخصی دارد که شایع ترین داده های ELISA گزارش شده است.
منحنی استاندارد ELISA
منحنی استاندارد یا کالیبراسیون عنصری از ELISA کمی است که امکان محاسبه غلظت آنتی ژن در نمونه را فراهم می کند. منحنی استاندارد از رسم غلظت های شناخته شده آنتی ژن مرجع در برابر بازخوانی به دست آمده برای هر غلظت (معمولاً چگالی نوری در ۴۵۰ نانومتر) به دست می آید. اکثر ELISA ریدرها یک نرم افزار برای ایجاد منحنی و تجزیه و تحلیل داده ها دارند. غلظت آنتی ژن در نمونه با برون یابی قسمت خطی منحنی استاندارد محاسبه می شود.
نمونه ای از منحنی استاندارد الایزا کمی
تست الایزا (آزمایش Elisa) معمولاً در یک پلیت چند چاهک (۹۶ یا ۳۸۴ چاهک) انجام می شود که سطح جامد را برای بی حرکت کردن آنتی ژن فراهم می کند. بی حرکتی آنالیت ها جداسازی آنتی ژن از بقیه اجزای نمونه را تسهیل می کند. این ویژگی ELISA را به یکی از آسانترین سنجشها برای انجام همزمان روی چندین نمونه تبدیل میکند.
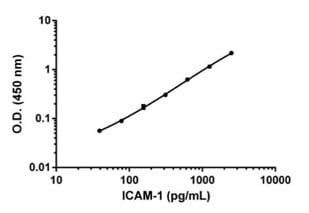
انتخاب کیت ELISA مناسب برای نمونه مورد نظر
ارزیابی دقیق عملکرد آزمایش اولین گام مهم در انتخاب کیت ELISA جدید است. پارامترهای مهم شامل حساسیت، محدوده دینامیکی و دقت است که برای اکثر کیت های ELISA گزارش شده است. سایر پارامترها عملکرد ELISA را برای انواع نمونه معمولی پیش بینی می کنند. درصد بازیابی و خطی بودن رقت، پروتئین هدف را در نمونه های واقعی مانند پلاسما، سرم یا محیط کشت سلولی اندازه گیری می کند.
خلاصه پارامترهایی که باید هنگام انتخاب کیت الایزا به دنبال آنها باشید:
| پارامتر | ملاک پذیرش |
| حساسیت | *به پروتئین هدف بستگی دارد |
| محدوده دینامیکی | *به پروتئین هدف بستگی دارد |
| CV (%) برای دقت intra-assay | ≤ ۱۰% |
| CV (%) برای دقت inter-assay | ≤ ۱۵% |
| اختصاصیت | واکنش پذیری را با پروتئین های بسیار همولوگ مورد بررسی قرار دهید |
| % بازیابی | %۸۰≥ |
| خطی بودن رقت | ≤ ۱۵% تفاوت با نمونه های رقیق نشده |
نکته مهم
برای بررسی مناسب بودن حساسیت و محدوده دینامیکی یک ELISA مشخص، مهم است که بدانیم چه سطحی از پروتئین مورد نظر در یک نمونه مورد انتظار است. نمونه هایی با غلظت بالایی از پروتئین هدف را می توان رقیق کرد تا سیگنال خام در محدوده دینامیکی مورد سنجش قرار گیرد.
حساسیت
حساسیت پایین ترین سطح پروتئینی است که جفت آنتی بادی مورد استفاده در کیت الایزا می تواند به دقت تشخیص دهد.
محدوده دینامیکی
محدوده دینامیکی به عنوان غلظت های بالا و پایین پروتئین هدف تعریف می شود که سنجش می تواند به دقت کمیت کند. مقادیر گزارش شده برای حساسیت و محدوده دینامیکی می تواند گمراه کننده باشد زیرا اغلب با استفاده از پروتئین استاندارد در بافرهای ساده تعیین می شود که ممکن است نشان دهنده سینتیک تشخیص یک پروتئین درون زا در یک نمونه بیولوژیکی نباشد.
CV
CV (%) یا ضریب تنوع نشان می دهد که میزان سازگاری سنجش چقدر است. CV به طور کلی برای ارزیابی ثبات بین دقت inter-assay یا plate to plate و دقت intra-assay یا سازگاری بین تکرارهای اجرا شده در همان آزمایش محاسبه میشود. CVهای کمتر از ۱۵ درصد inter-assay عموماً قابل قبول هستند. درصد CVهای intra-assay باید کمتر از ۱۰ باشد.
اختصاصیت
مهم است که آنتی بادی های مورد استفاده در کیت ELISA با پروتئین های غیر هدف واکنش متقابل نداشته باشند. اینها می توانند پروتئین هایی با همسانی بالا در بین گونه ها باشند.
درصد بازیابی
درصد (%) بازیابی با متصل کردن مقدار مشخصی از پروتئین هدف خالص شده در یک نوع نمونه بیولوژیکی (همچنین به نام ماتریس نمونه) تعیین میشود. برای پروتئین های ترشح شده مانند سیتوکین ها، ماتریس های نمونه معمولی پلاسما و سرم هستند. برای پروتئین های داخل سلولی مانند کینازها، نمونه ها لیزات کشت سلولی هستند. نمونه متصل شده در الایزا اندازه گیری می شود و غلظت آن از منحنی استاندارد محاسبه می شود. این غلظت محاسبه شده با غلظت شناخته شده پروتئین مقایسه می شود و به صورت درصد بیان می شود. به عنوان مثال، بازیابی ۱۰۰٪ به این معنی است که غلظت مشاهده شده با غلظت واقعی پروتئین مشخص شده در نمونه یکسان بود. این نشان میدهد که پروتئینها و سایر مولکولها در نوع نمونه در تعیین کمیت پروتئین تداخلی نداشتهاند. اگر درصد بازیابی کمتر از ۸۰ درصد برای یک نوع نمونه خاص باشد، باید یک کیت ELISA متفاوت برای تعیین کمیت انتخاب شود.
خطی بودن رقت
خطی بودن رقت همراه خوبی برای درصد بازیابی است، زیرا پروتئین اصلی را در نمونه های بیولوژیکی اندازه گیری می کند. خطی بودن رقت با اندازه گیری رقت های متعدد نمونه های مثبت شناخته شده توسط الایزا تعیین می شود. غلظت پروتئین هدف با ضرب ضریب رقت در غلظت محاسبه شده تعیین می شود. برای بهترین نتایج، غلظت نمونه ها باید برای همه رقت ها مشابه باشد. اگر اختلاف بیش از ۲۰ درصد از نمونه رقیق نشده مشاهده شد، باید یک کیت ELISA متفاوت برای تعیین کمیت دقیق انتخاب شود.
آماده سازی نمونه الایزا
این موارد دستورالعمل های کلی برای آماده سازی نمونه های آزمایش شده معمول برای استفاده در تست الایزا (آزمایش Elisa) هستند. مانند تمام جنبه های توسعه سنجش، روش های بهینه آماده سازی نمونه بسته به هدف و سنجش مورد علاقه متفاوت خواهد بود.
روش های آماده سازی نمونه
مایع رویی کشت سلولی
محیط کشت سلولی را در لوله سانتریفیوژ پیپت کرده و با سرعت ۱۵۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. بلافاصله از مایع رویی جدا کرده و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
عصاره سلولی
پلیت کشت بافت را روی یخ قرار دهید. محیط را آسپیره کنید و سلولها را یکبار با PBS سرد یخ بشویید. PBS را آسپیره کنید و ۰.۵ میلی لیتر بافر استخراج کامل را در هر پلیت ۱۰۰ میلی متری اضافه کنید. سلول ها را خراش دهید تا در پلیت کج شده جمع آوری شوند و در لوله از قبل سرد شده خارج شوند. برای مدت کوتاهی به صورت دورانی بچرخانید و به مدت ۱۵-۳۰ دقیقه روی یخ قرار دهید. با دور ۱۳۰۰۰ به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید تا محتویات نامحلول ته نشین شوند. مقدار کمی مایع رویی (این عصاره سلولی محلول است) را به درون لوله های تمیز و سرد بریزید. نمونه ها در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
محیط شرطی شده
سلول ها را در محیط رشد کامل (حاوی سرم) قرار دهید و اجازه دهید سلول ها تا سطح تلاقی مطلوب تکثیر شوند. محیط رشد را بردارید و به آرامی با چند میلی لیتر PBS گرم بشویید. مرحله شستشو را تکرار کنید. آخرین شستشوی PBS را بردارید و به آرامی محیط رشد بدون سرم را اضافه کنید. ۱-۲ روز انکوبه کنید. محیط را داخل لوله سانتریفیوژ بریزید و با سرعت ۱۵۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. بلافاصله مایع رویی را جدا کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
شیر
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
پلاسما
خون کامل را در لوله های حاوی ضد انعقاد جمع آوری کنید، و ۰.۱مولار سدیم را به حجم نهایی۱۰/۱ اضافه کنید. با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. بلافاصله مایع رویی (پلاسما) را به مقدار کافی تقسیم کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
ادرار
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
بزاق
نمونه ها را جمع آوری کنید و در ۱۰۰۰۰ x g به مدت ۲ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. مایع رویی را به مقدار کافی استفاده کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
سرم
خون کامل را در لوله آزمایش ، به عنوان مثال، یک لوله بدون ضد انعقاد جمع آوری کنید. بدون مزاحمت در دمای اتاق به مدت ۲۰ دقیقه انکوباسیون کنید. با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. بلافاصله مایع رویی (سرم) را به مقدار کافی تقسیم کنید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
عصاره بافت
بافت مورد نظر را با ابزار تمیز، ترجیحاً روی یخ و در اسرع وقت تشریح کنید تا از تخریب توسط پروتئازها جلوگیری شود. دستمال را در لوله های میکروفیوژ ته گرد قرار دهید و در نیتروژن مایع غوطه ور کنید تا به سرعت یخ بزند. نمونه ها را برای استفاده بعدی در دمای ۸۰- درجه سانتیگراد نگهداری کنید یا برای همگن شدن فوری روی یخ نگه دارید. برای یک قطعه ۵ میلی گرمی از بافت، ۳۰۰ میکرولیتر بافر استخراج کامل به لوله اضافه کنید و با هموژنایزر الکتریکی همگن کنید. تیغه را دو بار با استفاده از بافر استخراج کامل ۳۰۰ میکرولیتری برای هر شستشو بشویید، سپس به مدت ۲ ساعت در دمای ۴ درجه سانتیگراد هم زدن را ثابت نگه دارید (مثلاً روی شیکر اوربیتال در اتاق سرد قرار دهید). به مدت ۲۰ دقیقه در ۱۳۰۰۰ دور در دقیقه در دمای ۴ درجه سانتی گراد سانتریفیوژ کنید. روی یخ، مقدار کمی مایع رویی (این عصاره پروتئین محلول است) را در یک لوله تازه و خنک قرار دهید و نمونه ها را در دمای ۸۰- درجه سانتی گراد نگهداری کنید. چرخه های انجماد/ذوب را به حداقل برسانید.
نمونه کنترل های مورد نیاز برای روش های الیزا
کنترلهای مناسب به شما کمک میکند تا نتایج مثبت واقعی را از نتایج نادرست تست الایزا (آزمایش Elisa) تفکیک نمایید. اگر زمانی نیاز به عیب یابی پروتکل خود داشته باشید، کنترل های مثبت و منفی نیز مفید خواهند بود.
کنترل مثبت
از یک نمونه محلول درون زا (endogenous) که حاوی پروتئینی است که شما شناسایی می کنید یا از یک پروتئین یا پپتید خالص شده که حاوی توالی ایمونوژن برای آنتی بادی مورد استفاده شما است استفاده کنید. یک نتیجه مثبت از کنترل مثبت، حتی اگر نمونه ها منفی باشند، نشان دهنده بهینه سازی و کارکرد درست روش است و بررسی می کند که هر گونه نتیجه منفی بدست آمده معتبر است. توصیه میشود برگه اطلاعات آنتی بادی را مطالعه کنید. اغلب یک کنترل مثبت پیشنهادی را ارائه می دهد. اگر کنترلی پیشنهاد نمی شود، موارد زیر را توصیه می کنیم:
- هر بافت، سلول یا لیزاتی که با موفقیت مورد استفاده قرار گرفته باشد می تواند یک کنترل مثبت مناسب در نظر گرفته شود.
- سعی کنید به پیوندهای پایگاه داده Swiss-Prot یا Omnigene در دیتاشیت نگاه کنید. این پایگاههای داده اغلب دارای فهرستی از بافتهایی هستند که پروتئین در آنها بیان میشود. اینها همچنین میتوانند کنترلهای مثبت مناسبی در نظر گرفته شوند.
- ورودی GeneCards را برای پروتئین بررسی کنید. زیرا معمولاً سطوح نسبی بیان را در بافت های مختلف برای شما فراهم می کند.
- اگر هنوز در یافتن یک کنترل مناسب مشکل دارید، توصیه می کنیم یک جستجوی سریع در PubMed انجام دهید تا ببینید کدام بافت ها و سلول ها پروتئین مورد نظر را بیان می کنند.
کنترل منفی
کنترل منفی نمونه ای است که می دانید پروتئینی را که شما تشخیص می دهید بیان نمی کند. کنترل منفی به منظور بررسی اتصالات غیر اختصاصی و مثبت کاذب است. هر پلیتی که استفاده می کنید باید حاوی یک نمونه کنترل منفی باشد تا نتایج را تایید کند.
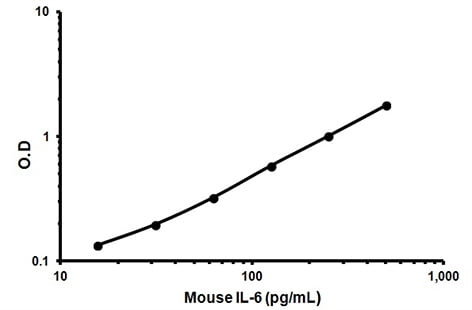
استاندارد
نمونه ای است که حاوی غلظت مشخصی از پروتئین هدف است که منحنی استاندارد را می توان از آن به دست آورد. به عنوان مثال، در زیر یک منحنی استاندارد معمولی از کیت الایزا IL6 موشی با غلظت ۱۵.۶ تا ۵۰۰ میکروگرم در میلی لیتر آورده شده است. منحنی استاندارد ضعیف به این معنی است که آنتی بادی به درستی متصل نشده یا استاندارد پروتئین را نمی گیرد. مقدار R2 خط روند باید > 0.99 باشد.
استاندارد در کنترل ماتریس نمونه (کنترل اسپایک)
هنگام (آزمایش Elisa) نمونه های سرم در الایزا، طبق معمول یک استاندارد در بافر رقیق کننده معمولی قرار دهید. اما توصیه می کنیم یک استاندارد رقیق شده در سرم گونه ای که در حال آزمایش هستید نیز اضافه کنید. سپس می توان این دو را با هم مقایسه کرد تا اطمینان حاصل شود که هیچ تأثیری بر منحنی استاندارد سایر پروتئین های سرم وجود ندارد که به عنوان کنترل اسپایک شناخته می شود و به شما می گوید که یک پروتئین هدف پس از قرار گرفتن در ماتریس قابل بازیابی است. نتایج قابل قبول ۸۰-۱۲۰٪ است.
کنترل مثبت درون زا (Endogenous)
اگر در حال (آزمایش Elisa) یک نمونه پروتئین نوترکیب هستید، توصیه میکنیم که یک کنترل مثبت درون زا اضافه کنید که باید جزء ضروری آزمایش شما باشد. مشکلات طبیعی با تشخیص آنتی بادی پروتئین های نوترکیب وجود دارد که باید در نظر گرفته شود. تا شدن پروتئین نوترکیب ممکن است با شکل بومی درون زا متفاوت باشد و ممکن است از دسترسی آنتی بادی به اپی توپ جلوگیری کند به ویژه در مورد پروتئین های برچسب گذاری شده نیز صادق است. همیشه از قرار دادن برچسب ها در انتهای N یا C ترمینال پروتئین نوترکیب اطمینان حاصل کنید. مهمتر از همه، همیشه مطمئن شوید که پروتئین نوترکیب شامل توالی ایمونوژن آنتی بادی است که استفاده می کنید. یک کنترل مثبت درون زا برای تأیید نتایج مهم است، و همچنین نشان می دهد که واکنشگرها (مثلاً آنتی بادی ها) و روش چقدر خوب کار می کنند.
نظرات (0)
اولین کسی باشید که دیدگاهی می نویسد “48. کارگاه کاربری دستگاه الایزا” لغو پاسخ
















نقد و بررسیها
هنوز بررسیای ثبت نشده است.